[2012·南通二调]碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
为探究Na、M g、Al的金属活动性顺序,某课外小组同学进行了如下实验:
g、Al的金属活动性顺序,某课外小组同学进行了如下实验: 他们记录的实验现象有:
他们记录的实验现象有:
| 实验 现象 |
①剧烈反应,迅速生成大量的气体。 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③反应不剧烈,产生无色气体。 ④有气体产生,溶液变成红色。 |
请帮助该小组同学补充下列实验报告中的内容。
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 |
1 |
2 |
3 |
4 |
| 实验现象 |
(2)写出钠与水 反应的化学方程式___________________________________。
反应的化学方程式___________________________________。
(3)实验结论是______________________________________。
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐_________,原子核对电子的引力逐渐增强,失电子能力逐渐_________,因此_________逐渐减弱。
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。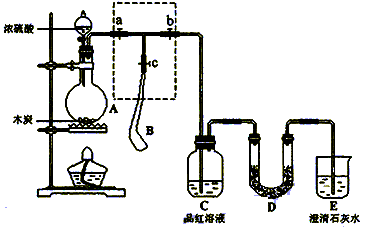
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为;
(4)当D中产生(多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为。
(Ⅰ)某校合作探究小组利用业余时间上网搜索烯类化合物与溴加成反应的有关信息,获得的有关结构与数据列表如下(以乙烯为标准)
| 烯类化合物 |
相对速率 |
| (CH3)2C=CHCH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
(1)据表中数据,总结烯类化合物加溴时,反应速率与碳碳双键上取代基的种类、个数间的关系:_________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是_________。
A.(CH3)2C=" C" (CH3)2B.CH3CH=CHCH3 C.CH2=CH2D.CH2=CHCl (Ⅱ)另一合作探究小组根据所学知识归纳整理乙醇、水、苯酚、碳酸( HO—C—OH)、乙酸分子中羟基上氢原子的活泼性。O
(Ⅱ)另一合作探究小组根据所学知识归纳整理乙醇、水、苯酚、碳酸( HO—C—OH)、乙酸分子中羟基上氢原子的活泼性。O
(1)甲同学将一些化学实验收集整理如下:
A.金属钠分别与水和乙醇反应 B.苯酚、二氧化碳、乙酸分别与氢氧化钠溶液反应
C.向二氧化碳水溶液、乙酸溶液中分别滴加紫色石蕊试液
D.将鸡蛋壳破碎后加入到醋酸溶液中 E.向苯酚溶液中滴加FeCl3溶液
F.向苯酚钠溶液中分别通入二氧化碳和滴加盐酸
其中能说明水比乙醇强的是(填字母,下同),乙酸比碳酸强的是。
(2)乙同学与其他同学合作,设计了一个简单的一次性完成的实验装置来验证乙酸、碳酸和苯酚溶液的酸性强弱,以说明其羟基上氢原子的活泼性顺序。根据下列实验装置图回答有关问题。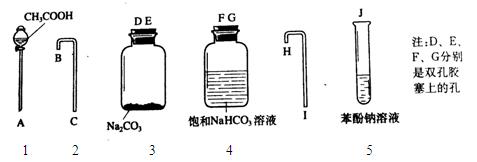
① A对应的仪器名称是;
② 各仪器的连接顺序是(填数字,仪器可重复使用);
③ 饱和NaHCO3溶液作用是;
④ 实验过程中观察到的现象有。
⑴、下列说法正确的是(填序号)。
①油脂水解可得到氨基酸和甘油
②水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精;
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离;
④制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
⑤淀粉水解后,取部分溶液加入碘水,溶液变蓝,说明淀粉未水解。
⑥不慎把苯酚溶液沾到了皮肤上,应立即用酒精洗涤。
⑦少量稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚。
⑧用浓氨水洗涤做过银镜反应的试管
⑨配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
⑩蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
⑵甲醇、乙醇、丙醇均能与水以任意比混溶,原因是
⑶、写出五种化学性质不同,且在同类物质中分子量最小的有机物的结构简式,这些物质燃烧
V(CO2):V(H2O)=1:1,这些物质是__________、____________、____________、____________、___________。
⑷ 写出蔗糖水解的方程式
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: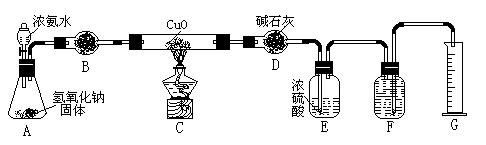
(1)写出氨气与氧化铜反应的化学方程式:。
(2)在A的锥形瓶中放入NaOH固体的目的是。
(3)在干燥管B中不能选用的干燥剂是(填序号);
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
(4)E装置中盛装浓硫酸的目的是:;
( 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.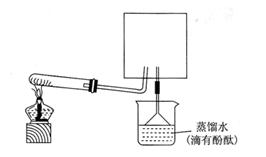
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
。