用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视 ;
在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
| 滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为;
(3)C装置中的反应的化学方程式为。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、CO32-、OH
、CO32-、OH 和SO
和SO 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
 预期现象和结论 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 mol L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
| 步骤2:向A试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为;
(3)C装置中的反应的化学方程式为。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、CO32-、OH
、CO32-、OH 和SO
和SO 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
 预期现象和结论 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 mol L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
| 步骤2:向A试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |
工业上测量SO2.N2.O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2.O2不与I2反应): 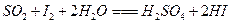 。
。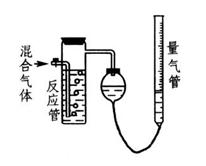
(1)混合气体进入反应管后,量气管内增加的水的体积等于____________的体积(填气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得SO2含量_______(填“偏高”.“偏低”.或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用______________代替(填写物质名称)。
(4)将上述装置改为简易实验装置,除导管外,还需选用的仪器为_______________(填仪器编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞
g.双孔塞
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白: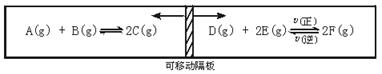
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于__________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”“不相等”或“不能确定”)。其理由是_______________________。
氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: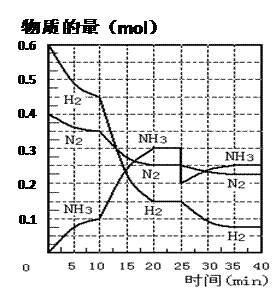
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:,
第2次平衡的时间范围为:,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) +  O2(g);△H =" a" kJ·mol—1
O2(g);△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0;ΔS0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: