在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白: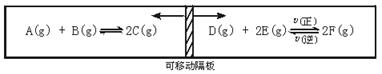
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于__________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”“不相等”或“不能确定”)。其理由是_______________________。
(1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置: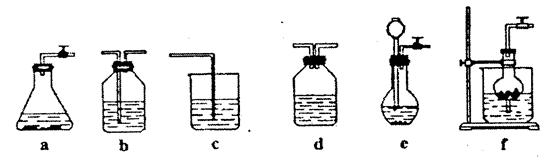
请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
| 分项 内容 |
CO2发生装置(X) 随开随用,随关随停 |
除杂洗气装置(Y) |
制备产品装置(Z) |
| 选择的装置(填序号) |
C |
||
| 选择的药品(填序号) |
① |
(2)如何检验所选择的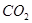 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量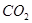 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量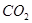 后,Z装置内的溶液中离子浓度大小顺序为:_______________________。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________。
某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,
又可用于验证物质的性质。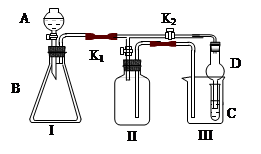
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO 等气体,其理由是:__________________________________
____________________________________________________________________
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法___________________________。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭),如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加___________,C中加_________,观察到C中的现象是__________________。
(3) 请利用I、III 装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加___________,B中加___________,C中加____________
现象:____________________,结论:_________________________________________。
在实验室中学生用下左图装置制取乙酸乙酯。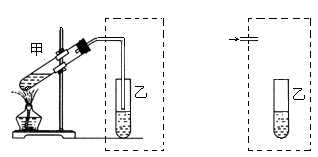
写出该反应的化学方程式______________________________。
回答下列问题:
(1)在大试管中加入浓硫酸3mL、冰醋酸3mL(3 g)、乙醇4mL(2.7 g),加入试剂的正确操作是__________________________________。
(2)装置中通蒸汽的导管只能插到饱和碳酸钠溶液的液面上方,不插入溶液中,作用是__________,长导管的作用是_______________。试设计另一个装置也能实现上述两个作用,在虚线部分画出该装置简图。
(3)试管乙中的现象是_______ ,由此可知乙酸乙酯的物理性质有_________________ 。
(4)充分反应后,制得乙酸乙酯的质量_______________g。
(5)工业用石油裂解气的主要成分为原料制取乙酸乙酯,经过的反应类型(按反应顺序)是_________________________。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。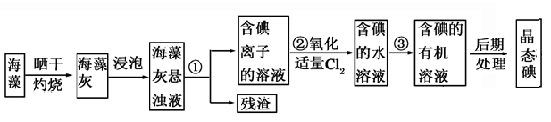
(1)指出提取碘的过程中有关的实验操作名称:①________________,③_______________。
写出实验②中有关反应的离子方程式:_________________________________。
(2)提取碘的过程中,可供选择的有关溶剂是________________________。
| A.甲苯,酒精 | B.四氯化碳,苯 | C.汽油,乙酸 | D.汽油,乙二醇 |
(3)为了使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、锥形瓶、酒精灯、导管、圆底烧瓶,石棉网以及必要的夹持仪器、物品。如上流程图所示,还缺少的玻璃仪器是___________________________________________________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处: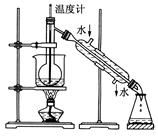
①______________________;
②__________________________;
③________________________。
(5)进行上述蒸馏法操作时,使用水浴的原因是___________________;最后,晶态碘在__________________里聚集。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验操作 |
实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mol.L-1的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
| 5.铝条与2 mol.L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
| 6.向AlCl3溶液滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:。
(2)实验用品:仪器:①②③④试管夹⑤镊子⑥小刀⑦玻璃片
⑧砂纸⑨滤纸⑩火柴等;
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、饱和的H2S溶液AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①②③④⑤⑥(用A-F表示)
写出操作3反应的离子方程式
(4)实验结论: