N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是______________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为________________。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。(填>、<或=)
(3)如右图所示装置可用于制备N2O5,则N2O5在电解池的______区生成,其电极反应式为_______。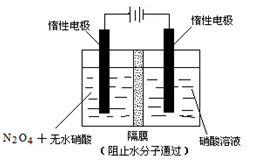
(5分)1999年1月,俄美科学家联合小组宣布合成出114号元素(Uuq)的一种同位素,该原子的质量数是289,试回答下列问题:
⑴该元素在周期表中位于第周期族,属于金属元素还是非金属元素?。
⑵该原子核内中子数为。
⑶写出该元素最高价氧化物对应水化物的化学式。
(14)下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。试回答下列问题:
| ① |
|||||||||||||||||
| ⑥ |
⑦ |
||||||||||||||||
| ② |
④ |
⑤ |
⑧ |
||||||||||||||
| ③ |
⑩ |
||||||||||||||||
| ⑨ |
⑴②、③、④三种元素最高价氧化物的水化物的碱性由强到弱的顺序是(填化学式)。
⑵10种元素中,原子半径最小的是(填序号)。
⑶元素⑦的氢化物分别与②和⑧的单质反应的离子方程式为,
。
⑷元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为。
⑸元素⑩的原子序数为,该元素在地壳中的含量居第四位,是目前应用最广泛的一种金属,其单质与⑧的氢化物的水溶液反应的离子方程式为。
⑹⑥与⑧形成化合物的化学式为;单质⑨溶于该化合物所得溶液呈色。
(6分)元素周期表中共有个横行,即个周期,其中长周期和短周期各个。除第1周期和第7周期外,每一周期的元素都是从元素开始,以元素结束。同一周期的主族元素,从左到右,原子半径逐渐,失电子能力逐渐,得电子能力逐渐;金属性逐渐,非金属性逐渐;最高价氧化物的水化物碱性逐渐,酸性逐渐。
2008年2月16日中国新闻网综合媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于_____ (填“金属”或“非金属”)元素,金属性比钙元素_____ (填“强”或“弱”),锶原子的核内质子数为_____ ,原子核外有_____个电子层,
其原子结构示意图为: _____ ,其原子半径_____镁(填“大于”、“小于”或“等于”);铯的原子核外共有_____层电子,最外层电子数为_____ 。
(2)铯与水起剧烈反应,放出_____色气体,同时使滴有紫色石蕊试液的溶液显_____色,因为_____ (写出化学方程式)。
(3)碳酸锶是_____色粉末,与盐酸反应的离子方程式为_____ 。
A、B、C、D 4种元素的核电荷数依次增加,他们的离子电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答下列问题:
(1)这4种元素的符号依次是A _____ ,B _____ ,
C _____ ,D _____ 。它们的原子半径由大到小的顺序是_________________ 。
(2)分别写出这4种元素的最高价氧化物对应水化物的化学式:_________________ ,
分别比较酸性和碱性的强弱: _________________ 。
(3)写出气态氢化物的化学式: _______________ 。比较其稳定性:______________,理由是_________ 。