在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断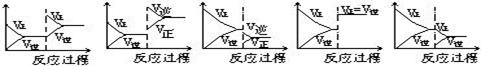
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是 (4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
(1)下列叙述中,正确的是(填写序号)。
①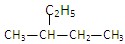 的化学名称是2—乙基丁烷
的化学名称是2—乙基丁烷
②有机物用NaOH水溶液水解后,加AgNO3溶液有沉淀产生,则该有机物为卤代烃
③能聚合成高分子化合物的单体中都含有碳碳双键
④苯和甲苯可以用0.1%KMnO4酸性溶液鉴别
(2)写出下列反应的化学方程式,并指出反应类型:
①把Cl2通入含铁的苯中()
②把浓H2SO4、浓HNO3和甲苯混合加热制备TNT( )
③由丙烯制备聚丙烯()
④甲苯在催化剂存在条件下加热与H2反应()
下列有机物中(1)属于脂肪烃的是_______________(填符合题意各物质的序号,下同),(2)属于芳香烃的是________,(3)属于苯的同系物的是________。(4)属于脂环烃的是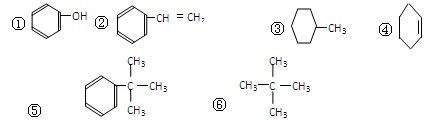
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O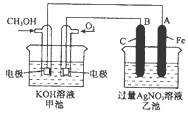
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:氧化反应式;还原反应式。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为。
下图所示水槽中试管内有一枚铁钉,放置数天后观察: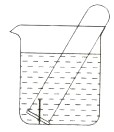
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀,正极反应式为。