将1molI2(g)和2molH2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g) ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
2HI(g) ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示: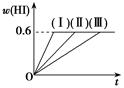
(1)达到平衡时,I2(g)的物质的量浓度为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示。则甲条件可能是____,乙条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
在新疆与青海两省区交界处有一狭长山谷,就是风和日丽的晴天也会倾刻间电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。
“魔鬼谷”牧草茂盛,四季常青的原因何在?请用化学方程式表示:
________________________、______________________、_________________________。
某同学发现他家蔬菜地中的蔬菜生长迟缓,便施用一种氮肥,下图是氮肥包装标签的部分文字。
(1)写出工业制备该氮肥的化学方程式_______________________________________
________________________________________________________________________。
(2)说明该氮肥能否与草木灰混合使用________________________________________
________________________________________________________________________。
(3)该氮肥的纯度是________。
(1)生物有机体维持生命所必需的化学元素有40多种,其中占原生质总量95%以上的有__________________(填元素符号),这些元素被称为基本元素。这些元素组成的氧化物中,属于酸酐的是_________________________________________________________。
(2)化肥厂合成氨的化学方程式是______________________________;
反应条件是根据_____________________________________________来选择的。
阅读下面的图表和短文,简要回答问题: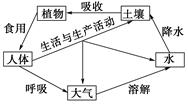
土壤污染是指土壤中积累有毒、有害物质,危害植物生长,或者残留在农作物中进入食物链而危害人体健康。人从自然界取得资源和能源,经过加工、调配和消费,最终以废弃物撒向土壤,或通过大气、水体和生物向土壤中排放和转移。当输入的污染物数量超过土壤的容量和自净能力时,必然引起土质的恶化,发生土壤污染。污染的土壤对农作物生长不利。
设计实验测定本地区土壤的酸碱性。(简要写出操作步骤)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
据你所学化学知识提出防止土壤污染的措施。(至少3种)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
我市某中学的同学自制一种黄色花汁,加入到不同试剂中,观察到的现象如下:
| 试剂 |
稀盐酸 |
食盐水 |
蒸馏水 |
草木灰水 |
石灰水 |
| 颜色 |
红 |
黄 |
黄 |
绿 |
绿 |
小强同学根据以上信息进行如下实验:
(1)用该花汁去检验附近小化工厂排放废水的酸碱性,显浅红色,则此废水显________性。
(2)用该花汁测知家中花盆土壤显酸性,打算加入上表中的____________________来改良。