I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,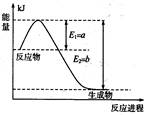
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为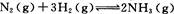 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为▲。(填字母)
A.用冰水混合物B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因▲,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应▲。
表1不同pH下二氧化锗的溶解率
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为。
(2)上述反应中产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为L。若准确测得的实际体积小于理论值(计算值),请分析可能原因。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下: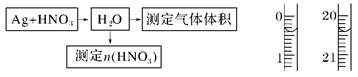
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为。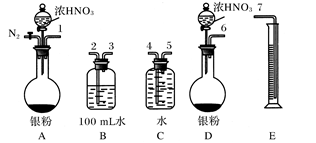
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
已知A、B、E是常见的非金属单质,C是导致酸雨的主要成分之一,Y是生活中常见的金属单质。D、K是重要的无机化工产品。X含有两种元素,具有摇篮式的分子结构,其球棍模型如图所示。H为白色沉淀。下列转化关系中部分反应条件和产物略去。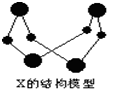
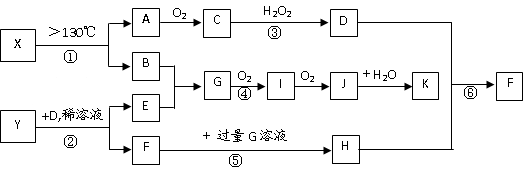
试回答下列问题
(1)X的化学式为: ▲ ;G的电子式 ▲ ;
(2)反应④的化学方程式:▲;
反应③的离子方程式: ▲;
(3)①~⑥反应中属于氧化还原反应的是(填编号) ▲;
(4)已知在真空中,将A与CuO按物质的量1:1反应可生成A2O。写出该反应的化学方程式:▲;
(5)依据实验中的特征实验现象,可确定Y是何种金属,该实验现象为▲。
(16分)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是▲(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如右图所示。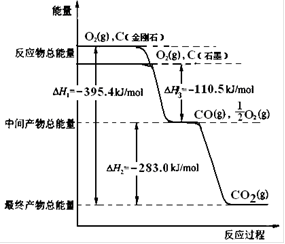
(a)在通常状况下,金刚石和石墨中____▲___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____▲___ kJ·mol-1。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 ▲kJ。
(3)已知:N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
综合上述有关信息,请写出CO除NO的热化学方程式▲ 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。
(4)研究表明,电池的正极用二氧化锰纳米棒为材料可提高发电效率,这是利用纳米材料具有
▲ 特性,能与钠离子充分接触。
(5)海水中的“水”电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池负极反应式为▲;当生成1 mol Na2Mn5O10转移▲ mol电子。
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐;
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2;
步骤3:向步骤2所得的水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中;
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2;
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式▲。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是▲。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为▲。 (4)用如上图所示的实验装置可精制粗溴。
(4)用如上图所示的实验装置可精制粗溴。

 ①反应过程中需要对A容器加热,加热的方法是▲。
①反应过程中需要对A容器加热,加热的方法是▲。
图中冷却水应从B的▲口进入(填“a”或“b”)。
②C中加冰的目的是▲。