某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。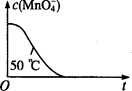
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂。请按要求填空:
(1)写出下列物质的化学式:A:________;B:________;C:________.
(2)写出F+B→I的化学方程式_________________________________.
(3)写出G和I的浓溶液反应的化学方程式_________________________
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一:
试回答下列问题:
(1)化合物III 在银氨溶液中发生反应化学方程式:;
(2)有机物 X 为化合物IV的同分异构体,且知有机物X 有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。
请写出化合物X的结构简式;
(3)下列说法正确的是;
| A.化合物I遇氯化铁溶液呈紫色 | B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗 9.5molO2 | D.1mol化合物III最多能与3 molH2 反应 |
(4)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则 R 在NaOH 醇溶液中反应的化学方程式为。
有机物A有下列转化关系,已知等物质的量的B和C完全燃烧后产生的CO2的量相等。
|


|
请回答:
(1)物质A和B的结构简式分别是__ __。(每个1分,共2分)有以下一系列反应,最终产物为草酸。已知B的相对分子质量比A大79。
A B
B C
C  D
D  E
E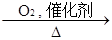 F
F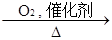 乙二酸(也叫草酸,分子式为C2H2O4)
乙二酸(也叫草酸,分子式为C2H2O4)
(1)B→C的转化条件是(1分)
(2)写出下列转化的化学方程式 (方程式每个2分,共8分)
① A→B ;
② D→E ;
③ E→F;
④E与乙二酸在某条件下1:1反应生成有机环状物;