某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20mL蒸馏水,加热至沸腾,然后向烧杯中滴加1mL~2mL饱和__________溶液,继续煮沸,至出现_________后,停止加热;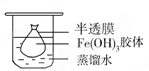
(2)将制得的胶体放入半透膜制成的袋内,如上左图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填写“有”或“无”)_________ 丁达尔现象:再向试管中加入用稀硝酸化的硝酸银溶液,可观察到的现象为______________________________;
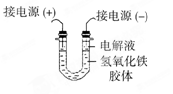
(3)将半透膜内的液体倒入U 型管中,如上右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)_____极附近颜色逐渐变深,其原因是_____________________________________。
(1)在一个容积为3L的密闭容器内进行如下反应:N2(气)+3H2(气)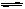 2NH3
2NH3
(气)。反应开始时,n(N2)=1.5mol,n(H2)= 4.4mol,2min后达到平衡状态,n(H2)=3.5mol。
用NH3的浓度变化来表示该反应的反应速率为___________________,2min末N2的浓度
________________,平衡时N2的转化率为______________________。
(2)在密闭容器中,对于反应:N2(g)+ 3H2(g)  2NH3(g),在反应起始时N2和H2分别
2NH3(g),在反应起始时N2和H2分别
为5mol和15mol,当达到平衡时,N2的转化率为20%。若以NH3为起始反应物,反应条
件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物
质的量为,NH3的转化率。
反应A(g)+B(g)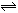 C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
(1)该反应是反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1,
E2_____(填“增大”“减小”“不变”)。
综合应用题:
Ⅰ.有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2⑤MgCl2⑥NH4Cl ⑦H2SO4⑧C2H5OH(酒精)(用序号作答)。
其中属于电解质的有,属于非电解质的有。
Ⅱ.今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol·L-1,SO42-的浓度是0.7mol·L-1。
(1)写出Al2(SO4)3电离的电离方程式:。
(2)Al3+浓度应等于mol·L-1。
Ⅲ.根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是,氧化产物是。
(2)该反应中被氧化的物质与被还原的物质物质的量之比为。
(3)用单线桥法标出电子转移的方向与数目。
离子反应方程式书写:(注意写化学方程式不给分)
(1)用盐酸中和烧碱,请写出其反应的离子方程式:。
(2)用稀硫酸清洗铁锈(Fe2O3),请写出其反应的离子方程式:。
(3)用足量的澄清石灰水检验二氧化碳,请写出其反应的离子方程式:。
(4)用铝片与硝酸汞溶液反应,请写出其反应的离子方程式:。
(5)用醋酸可以溶解碳酸钙,请写出其反应的离子方程式:。
(16分)Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+ 3H2
CO+ 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ: 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断 ΔH10 (填“>”、“=”或“<”)。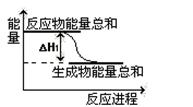
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.