短周期元素Q、R、T、P、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 ,用化学方程式表示工业上冶炼该单质的反应原理 。
(2)元素的非金属性:Q P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示) 。
(3)R的氢化物的结构式为 ,实验室检验该氢化物的方法是
_______________________________________________________________。
(4) W在周期表的位置为_________。W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为 。利用该气体的
性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气。
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式:。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:。
③写出步骤(Ⅲ)反应的离子方程式:。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42-的转化率。
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是。(填写序号)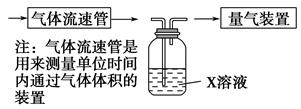
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO 的转化率,已知气体流速,还需测定的数据有、。
的转化率,已知气体流速,还需测定的数据有、。
如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。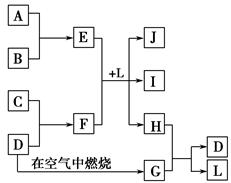
(1)框图中所列物质中属于非电解质的物质的化学式是。
(2)用电子式表示出H的形成过程。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为。
(4)F的水溶液中各离子浓度由大到小的顺序为。
(5)F的水溶液显碱性的原因:(用离子方程式表示)。
(6)E与F在L中反应的离子方程式为。
(7)H和G之间反应的化学方程式为。
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是(填化学式),反应的化学方程式为。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液,说明这种气体具有性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:。
(5)能否用澄清石灰水鉴别这两种气体?(填“能”或“不能”),若不能,请填写两种能鉴别的试剂。
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g样品与2.0 mol·L-1 NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示。请回答下列问题: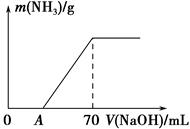
(1)A点前样品与NaOH反应的离子方程式为。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的(填字母序号)。
(3)样品中(NH4)2CO3的质量分数是%(保留一位小数)。
(4)当V(NaOH)=50 mL时,生成NH3的质量为。
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式。
(2)定出反应①②的化学方程式:
①,
②。
(3)写出反应③的离子方程式:。
(4)J与F反应的化学方程式:。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为mol。