Ⅰ.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC),PE和PVDC是安全的。PVC被广泛地用于食品、蔬菜外包装,它对人体的潜在危害主要来源于两个方面。一是产品中氯乙烯单体残留量(氯乙烯对人体的安全限量标准为小于1 mg/kg),二是加工过程中使用的加工助剂的种类及含量。现行国际标准和我国国家标准都允许限量使用己二酸二辛酯(即DOA)作为增塑剂(不超过35%)。化学工作者和广大消费者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步反应合成PVC:
乙是PVC的单体,其结构简式为 ,反应②的反应类型是 ____
(2)邻苯二甲酸二辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐( ) 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为 。
) 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为 。
(3)在适当的条件下,DMP经反应可得到芳香族化合物A(C8H6O4),1mol A与足量的NaHCO3溶液反应可放出CO2气体44.8L(标准状况下),1mol A在一定条件下和1 mol B反应生成 1 mol C和2 mol H2O,C的分子式为C10H8O4,请写出A和B反应的化学方程式___________________。
(4)A的同分异构体有很多,请写出任意一种既属于羧酸又属于酯的芳香族化合物的结构简式:: ;
Ⅱ.某可降解塑料的单体为D,经测定D的相对分子质量在90~120之间,其中含碳的质量分数为46.2%,含氢的质量分数为7.7%,其余为氧。请回答下列问题:
(1)D的分子式为 。
(2)1molD与足量NaHCO3反应得到22.4L(标准状况下)CO2,与足量金属钠反应,得到22.4L(标准状况下)H2。则D分子中含有的官能团的名称为
(3)在一定条件下,D可发生反应生成五元环,则D的结构简式为 。
(4)一定条件下D聚合成可降解塑料的化学方程式为 。
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混和气体,并使A和B容积相等(见下图)在保持400℃的条件下使之发生如下反应: 2SO2+O2 2SO3(气)
2SO3(气) 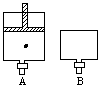
(1)达到平衡时所需的时间A容器比B容器____,A容器中SO2的转化率比B容器_____。
(2)达到(1)所述平衡后,若向两容器中通入等量的氩气,A容器化学平衡___移动,B容器化学平衡____移动
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到新平衡时:A容器中SO3的百分含量____(增大、减小、不变。下同),B容器中SO3的百分含量____。
已知氯水中有如下平衡:Cl2+H2O HCl+HClO,常温下,在一个体积为50 mL的针筒里吸入40 mL氯气后,再吸进10 mL水。写出针筒中可能观察到的现象
HCl+HClO,常温下,在一个体积为50 mL的针筒里吸入40 mL氯气后,再吸进10 mL水。写出针筒中可能观察到的现象 。
。
若将此针筒长时间放置,又可能看到何种变化;试用平衡观点加以解释。
现有 四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):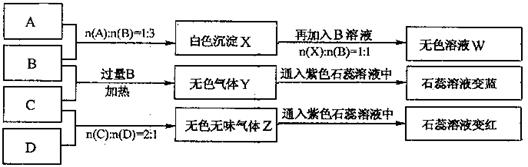
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为、。
(2)D溶液pH(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)
。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者后 者(填“<”“>”“=”)。
者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
25℃时,若体积为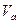 、pH=a的某一元强酸与体积为
、pH=a的某一元强酸与体积为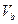 、pH=b的某一元强碱混合,恰好中和,且已知
、pH=b的某一元强碱混合,恰好中和,且已知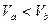 和a=0.5b,请填写下列空白:
和a=0.5b,请填写下列空白:
⑴a值可否等于3(填“可”或“否”)________,其理由是_______________________。
⑵a值可否等于5(填“可”或“否”)________,其理由是_____________________。
⑶试确定a的取值范围_________________________________。
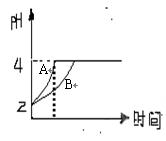
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位
同学的说法以评判(包括操作、现象和结论)
(2)常温下,取pH=2的盐酸和醋酸溶液各10 0mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
0mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)