铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。请回答下列问题:
2PbSO4+2H2O。请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。
(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。
下列有机物中(1)属于脂肪烃的是_______________,(2)属于芳香烃的是________,(3)属于苯的同系物的是________。(4)属于脂环烃的是(填序号)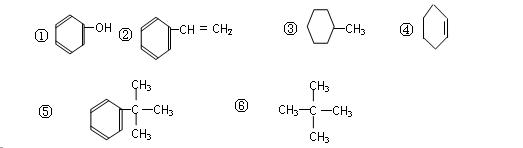
下列实验的操作或所用的试剂有错误的是
| A.实验室制取乙烯气体时,将温度计的水银球放入液面以下 |
| B.可用酒精洗涤沾有苯酚的试管 |
| C.证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 |
D.配制银氨溶 液时,将硝酸银 液时,将硝酸银 溶液逐滴滴入氨水中 溶液逐滴滴入氨水中 |
E.苯中混有苯酚,加浓溴水,然后分液
F、用浓氨水洗涤做过银镜反应的试管
金属的防腐常用方法有
| A.覆盖油漆 | B.覆 盖塑料 盖塑料 |
C.电镀金属 |
D.电化学保护法 E.制成不锈钢 E.制成不锈钢 |
请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号):
(1) 邮筒_________ (2) 手术刀________
(3) 海水中的钢闸门________(4) 电线__________
(5) 自行车的钢圈____________。
重金属盐能使人中毒。当人误食重金属盐时,可以喝_______________解毒。原因是上述食品中含有较多的______________,可以跟重金属盐形成不溶于水的化合物,可以减轻重金属盐类对胃肠黏膜的危害,起到缓解毒性的作用。
某药品标签上贴有 OTC,它表示_____________________,若是R标记则表示________ __,我们平时能自己到药店买到的药如阿司匹林属于哪类药__________________。
OTC,它表示_____________________,若是R标记则表示________ __,我们平时能自己到药店买到的药如阿司匹林属于哪类药__________________。