在精制饱和食盐水中加入碳酸氢铵,可制取小苏打(NaHCO3)并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是 (选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,一段时间后将溶液加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________;滤渣的主要成分是_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_____ _____。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+中只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中氢化物最稳定;Z的原子核内质子数是Y的最外层电子
数的2倍;F与Z同主族;E与X同主族。试推断:
⑴下列元素分别是:Y ZF。(用元素符号表示)
⑵X、Z、E形成化合物的电子式为,所含有的化学键有
;它属于化合物(填离子或共价)
非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题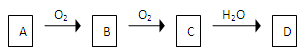
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是。
②在工业生产中,大量排放的B气体被雨水吸收后形成而污染环境
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是;。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
。
该反应(填属于或不属于)氧化还原反应。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
有右图装置:回答下列问题:
(1)装置A是_______池,B是_______池。
(2)装置A中的Zn极是_______极,
Cu极上的电极反应方程式为:__________________。
(3)装置B中是浓度均为1.0mol/L的NaCl、CuSO 混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
(4)欲用装置B给用来给餐具镀银,N应该是(填“银” 或“餐具”),电镀液的主要成分是(填化学式)。
(9分)(1)Na2CO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;(2)氯化铝水溶液呈性,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。