近几年我国某些城市酸雨污染较严重,主要是因为大量燃烧含硫量高的煤而形成的.
【提出问题】如何证明 。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4”.
(2)“二氧化硫和二氧化碳一样,能和澄清石灰水发生反应生成难溶于水的亚硫酸钙(CaSO3),也能使澄清石灰水变浑浊.”请写出二氧化硫使澄清石灰水变浑浊的化学方程式: .
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究.
【实验探究】
(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”:A ,B 。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(4)乙同学认为甲同学的实验方案不合理,其理由是: .
(5)丙同学:进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是 .
(7)丙同学的实验中若已证明煤中含有碳元素和硫元素的现象是:丙同学应看到的实验现象是 。
下图所示为实验室常用的实验装置: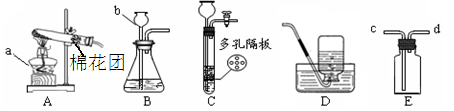
(1)写出下列仪器名称:a;b。
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是(填装置的字母代号),化学方程式是,用双氧水制取氧气的化学方程式为。
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是,若将E装置中收集的氢气排出,应从(填c或d)口通入蒸馏水。
(4)装置C相对于装置B在操作方面的优势为。
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一] 探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 |
乙 |
|
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为: ①>②>③。 |
 |
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知,,化学反应的速度越快; Ⅲ 对比甲同学实验(填实验序号)可知,反应物的接触面积越大,反应速率越。 Ⅳ 乙同学的实验中,数据记录纸上应该连续记录的实验数据是和。 |
[拓展实验二] 测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和。)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。下图(Ⅰ)为石头纸与稀盐酸反应的装置,图(Ⅱ)用于测量CO2的体积。
① 连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置(I)气密性(选填“良好”或“漏气”)
② 图(Ⅱ)装置中油层的作用是_;
③ 反应停止后,(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
A. 水平移动量气管 B.上下移动量气管 C. 封闭量气管
(7) 乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
| 第一份 |
第二份 |
第三份 |
第四份 |
|
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题:
① 在第1份样品的实验中,完全反应了。
② m为
③ 石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程,4分)
④ 请在坐标图中画出在6.25 g样品中加入稀盐酸的体积与产生气体质量的关系图。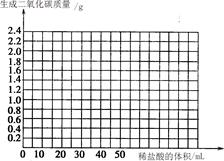
小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下:
| Al |
X |
Cu |
||
| 现象 |
开始时 |
几乎无气泡产生 |
产生气泡速律慢 |
无气泡产生 |
| 一段时间后 |
产生气泡速律快 |
产生气泡速律慢 |
无气泡产生 |
回答下列问题:
(1)实验开始时,铝表面几乎无气泡产生的原因是。
(2)Cu表面始终无气泡产生的原因是。
(3)三种金属的活动性由强到弱的顺序是。
(4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是(用离子符号表示)。
暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中CO2反应; 化学方程式为: |
| 可能是 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
经过反复思考,同学们认为白色粉末还可能是的混合物。
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解。于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是:。
| OH- |
Cl- |
CO32- |
NO3- |
|
| Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| ①取上述试管中上层清液,滴加1~2滴无色酚酞试液 |
①。 |
②。 |
| ②往上述试管中的残留的固体中加入稀盐酸 |
③。 |
④白色粉末中(选填“有”或“无”)CaCO3 |
| ③由上述实验可知白色粉末的成分是:。 |
(3)交流与反思:
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是(选填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
请根据下列实验装置图回答问题:
仪器a、b的名称分别是_______、________。
实验室制取氢气的发生装置应选择________(填装置编号),反应的化学方程式是______________。点燃氢气前一定要________。
甲烷是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。制取甲烷的装置应选择________;请写出甲烷完全燃烧的化学方程式______________________________。
(1)某同学用图1装置进行实验,目的用这个装置除去氧气中混有的少量二氧化碳气体。在A、B瓶中都盛放足量的澄清石灰水,问A瓶中澄清石灰水所起的作
用是,当观察到现象时,说明CO2已除尽。写出CO2与澄清石灰水反应的化学方程式
(2)该同学用图2装置,验证能使石蕊溶液变色的物质是碳酸而不是水或二氧化碳。为了能验证成功,该同学进行实验操作的顺序应是________(填序号,可重复选用)。① 从b端通氮气 ② 从分液漏斗中滴加适量水 ③ 从a端通二氧化碳 ④ 将石蕊溶液染成紫色的干燥纸花放入广口瓶中