已知A、B、C、D四种溶液分别为NaHCO3、Ca(OH)2、FeCl3、HCl,它们相互之间的反应现象如下表所示,其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示无现象。
(1)写出B的化学式 ,D的化学式 。
(2)写出B+C(过量)反应的离子方程式 。
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-)c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
双酚A,也称BPA,用来生产防碎塑料的原料。欧盟认为含双酚A奶瓶会诱发性早熟,从2011年3月2日起,禁止生产含化学物质双酚A的婴儿奶瓶。
(1)双酚A的结构简式如图Ⅰ所示。写出双酚A的分子式
(2)双酚A由苯酚和丙酮( 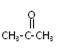 )在酸性介质中反应制得。写出反应的化学方程式
)在酸性介质中反应制得。写出反应的化学方程式
(3)以双酚A和光气(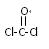 )为原料合成一种防碎塑料——聚碳酸酯,简称PC
)为原料合成一种防碎塑料——聚碳酸酯,简称PC
结构简式如图Ⅱ。以PC为原料制成的婴儿奶瓶在使用过程中会析放出极少量的双酚A,长期使用可能损害婴儿的健康。
①以双酚A和光气合成PC的反应属反应
②写出由PC析放出双酚A的化学方程式
(4)下列关于双酚A和PC的叙述中,正确的是( 双选 )
| A.双酚A分子中所有的碳原子都在同一平面上 |
| B.双酚A和PC都是芳香衍生物 |
| C.一定条件下双酚A和PC都可以和NaOH溶液反应 |
| D.一定条件下1mol PC可以和6mol H2发生加成反应 |
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为:  (其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
(其中Ⅰ、Ⅱ 为未知部分的结构),为推测X的分子结构,进行如下图所示的转化过程:
已知向D的水溶液中滴入FeCl3溶液显紫色,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物只有两种。
(1)D中含氧官能团名称,B→E的反应类型为;
(2)B和G在一定条件下可反应生成六元环状化合物的化学方程式:;
(3)X可能发生的反应有:(填字母标号)
| A.加成反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(4)D有多种同分异构体,其中核磁共振氢谱中只有4种峰的同分异构体的结构简式为:(任写两种)。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的该反应的反应速率为:,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 
①该电池正极的电极反应为。
② 用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为(填名称)。
乙烯和溴水反应主要生成A,同时还有B和溴乙烷生成。各物质的转化关系如下图。
已知:E的结构简式为 ,I的分子式为C4H4O4,是一种环状化合物。
,I的分子式为C4H4O4,是一种环状化合物。
请回答下列问题:
(1) E的分子式是_______;B的结构简式是___________________
(2) 在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是
_______,名称是______________
(3) 在反应①〜⑩中,属于取代反应的是⑥和_______(填写编号);
(4) 写出反应⑩的化学方程式__________ ___________
___________
(5) J是I的同分异构体,且1 mol J与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出一种符合条件J的结构简式_______