(12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。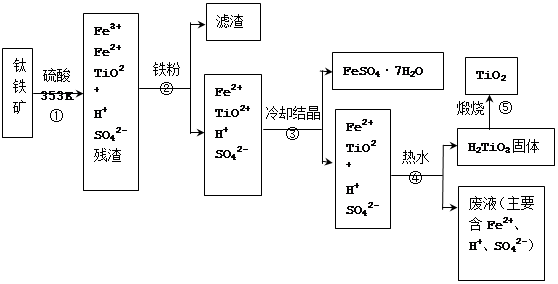
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是 (填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为 。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)
已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请下列问题:
(1)写出NaHSO4在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,则反应的离子方程式是 。
(4)若将NaHSO4溶液逐滴滴入Fe(OH)3胶体溶液可观察到的现象是 。
工业电解饱和食盐水模拟装置的结构如图所示: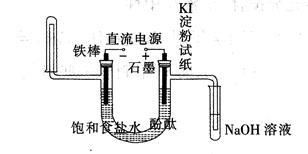
(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的 性;铁用作炊具是利用了铁的 性。
(2)常温下由于浓硫酸能使铁 ,因此浓硫酸可用铁槽车运输。
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,由此可知氢氧化铝是 物质。氢氧化铝和盐酸反应的离子方程式为 。
完成下列各题
(1)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是__(填“CaCl2”或“Ca(ClO)2”)。
(2)某些合成染发剂含有对苯二胺( ),有一定的致癌作用。对苯二胺属
),有一定的致癌作用。对苯二胺属
于 (填“有机物”或“无机物” )。
8.5 g NH3的物质的量是________mol,含有__________个氨分子,_________个原子,标准状况下占有的体积是___________L。