(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。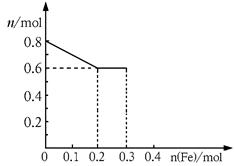
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
(10分) (1)已知某反应的各物质浓度数据如下:
_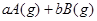

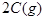
起始浓度(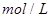 ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度(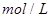 ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a=,b=。
②2s内B的转化率=。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有mol电子从通过电线到(填“铁片”或“碳棒”)。
④此时溶液中H+的物质的量浓度为(不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是(用含m的代数式表示。)
某苛性钾样品经分析含水:7.62%(质量分数,下同)、K2CO3:2.38%、KOH :90.00%。取此样品 1.00 g 放入 46.00 mL 1.00 mol·L-1的盐酸中,过量的 HCl 可用1.070 mol/L KOH(aq)中和至中性,蒸发中和后的溶液可得固体______________克。
5.3g Na2CO3正好与20mL盐酸完全反应(Na2CO3+2HCl=2NaCl+CO2↑+H2O)。问这种盐酸的物质的量浓度c(HCl)=________________________产生的CO2在标准状况下的体积V(CO2)="_____________________"
在100mL 2mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1,求产生的沉淀的质量?