(8分)在有机物分子中,常把连有4个不同原子或原子团的碳原子称为“手性碳原子”。含有手性碳原子的分子一般都具有某些光学活性。经测定某新合成物A具有光学活性,其结构简式为:CH3COOCH2CH(CH2OH)CHO。若要在保持A分子中碳原子数不变的前提下,通过适当的反应使A失去光学活性,有两种方法:
(1)有机反应类型:__________反应,对应有机物的结构简式_______________;
(2)有机反应类型:__________反应,对应有机物的结构简式_______________。
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下: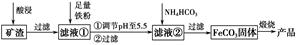
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。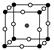
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+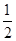 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:____________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中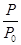 与时间t的关系如图所示。
与时间t的关系如图所示。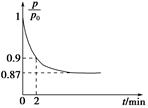
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
过硫酸钾(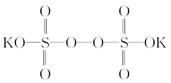 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: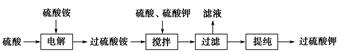
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。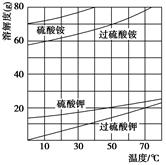
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。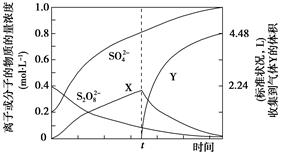
氟化铜是一种锂/氟化铜电池正极活性材料,可通过下列方法制备:在铂皿中将氧化铜用过量的40%氢氟酸溶解,先制成CuF2·5HF·5H2O,再将生成物放入镍管内的铂舟中,在干燥的氟化氢气流中以400%进行加热脱水,最后通入氮气。
(1)制备过程中用铂皿而不用玻璃器皿的原因是______________________________________(用化学方程式表示)。
(2) 锂/氟化铜电池放电时总反应为置换反应,其化学方程式为____________________________________________________。
(3)准备称取上述制备的样品(仅含CuF2和CuO) 2.120 g,在通风橱中加入稀硫酸至完全溶解,然后加入足量的氢氧化钠溶液,得沉淀,将沉淀充分灼烧,得1.680 g黑色固体,计算样品中CuF2和CuO的物质的量之比。