决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长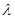 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
。(未说明原因不给分)
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。
A.离子键 B.共价键 C.配位键 D.氢键
熟悉和使用中学化学实验中常见仪器及用途,是化学学习的基本要求。试回答下列问题。
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是________(填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题: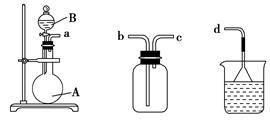
甲 乙 丙
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a―→____―→_____―→d(填接口代号)。
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO-D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为___________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子,请简述实验操作步骤、现象及结论:__________________________________________。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:
已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
| 沉淀开始时pH |
2.7 |
4.1 |
8.3 |
| 沉淀完全时pH |
3.7 |
5.4 |
9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。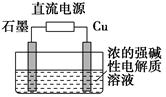
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。