抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③ + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式: MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
向50mLNa2SO4和Na2CO3的混合溶液中加入过量BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量稀HCl,充分反应后沉淀减少到4.66g,并有气体产生。
⑴求原混合物溶液中Na2SO4和Na2CO3的物质的量。
⑵求产生的气体在标准状况下的体积。
在标准状况下,15g二氧化碳和一氧化碳组成的混合气体,其体积为10.08L,则此混合气体中,一氧化碳和二氧化碳的物质的量之比为多少?
常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为2.0g /cm3,求:
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度
(3)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比。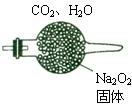
现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):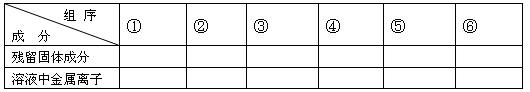
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。