为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据合理(除W0外)的是( )
| |
实验方法 |
实验方案 |
测量数据 |
| A. |
滴定法 |
将样品配成100 mL溶液,取10 mL,加入甲基橙,用标准盐酸滴定 |
消耗盐酸的体积 |
| B. |
量气法 |
将样品与盐酸反应,生成的气体全部被碱石灰吸收 |
碱石灰增重 |
| C. |
重量法 |
样品放入烧瓶中,置于电子天平上,加入足量盐酸 |
减轻的质量 |
| D. |
量气法 |
将样品与盐酸反应,气体通过排水量气装置量气 |
排水体积 |
下列说法错误的是
| A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下 |
| D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中 |
能用H++OH-=H2O来表示的化学反应是
| A.氢氧化铁和稀盐酸反应 |
| B.氨水和稀硫酸反应 |
| C.氢氧化钠溶液和稀硝酸反应 |
| D.二氧化碳通入澄清石灰水 |
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S 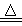 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
| A.该反应的氧化剂只有Cu2O |
| B.Cu既是氧化产物又是还原产物 |
| C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol |
| D.该反应中氧化产物与还原产物的质量比为1∶6 |
在下列条件下,能大量共存的微粒组是
| A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
| B.右表提供的数据下:HClO 、HCO3-、ClO-、CO32- |
| C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- |
| D.中性的溶液中:CO32-、Na+、SO42-、AlO2- |
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,
下列有关说法中不正确的是
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色外环呈红色或浅红色 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |