(8分)现有CH4、C2H4、C2H6三种有机物:
(1)等质量的以上三种物质完全燃烧时耗去O2的量最多的是________;生成CO2量最多的是________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)在120 ℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
(1)在反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中, ___元素被氧化,____元素被还原,是氧化剂;是还原产物(填相应的元素符号或化学式);若标准状况下产生2.24L Cl2,则电子转移的总数是NA.
(2)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O 、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2 →O2。
①写出该未配平的离子方程式。
②如果上述反应中有11.2L(标准状况)气体生成,则被还原的物质为mol。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连。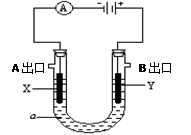
请回答以下问题:
(1). 若a是CuCl2溶液,则
①X电极的现象是,
电极反应式是。
②在B出口放一块湿润的KI-淀粉试纸会变为色。
(2).若a饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是。
在X极附近观察到的现象是。
② Y电极上的电极反应式是。
(3). 若a是400mL 2mol /LCuSO4 溶液,一段时间阴极增重1.28g(该极无气体放出),则溶液的PH为,阳极可收集标况下气体mL
“神九”飞船的发射成功,标志着我国航天事业进入领先行业。
(1).燃料电池的发展和航天的需求密不可分。燃料电池不仅能量转换率高,而且以氢气和氧气为燃料的电池,电池反应生成的水还可供宇航员饮用。
①使用酸性电解质的氢氧燃料电池,负极的电极反应为。
②美国的阿波罗登月飞船使用的是碱性氢氧燃料电池,正极的电极反应为
O2 + 2H2O + 4e- = 4OH-,负极的电极反应为。
③下图是熔融碳酸盐燃料电池的工作原理示意图。
已知负极的电极反应为2 H2 – 4e-+ 2CO32- ="2" H2O +2CO2,
正极的电极反应为。
(2).太阳能电池也为航天飞船提供了方便的能源。在航天飞船内H2O和O2的循环中,借助太阳能电池,可以通过电解水提供O2。若有4 mol电子发生转移,则在阳极上得到气体的体积(标准状况)是L。
在常温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)。
(10分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1).该反应的平衡常数表达式K=。
(2).830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=mol·L-1,若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3).1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。