北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的
(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3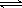 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
在一密闭容器内盛由HBr气体。在一定温度下进行反应:
2HI(g) H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则
H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则
①正反应速率___________,逆反应速率___________(填“加快”“减慢”或“不变”)
②化学平衡向__________________移动(填“正反应方向”“逆反应方向”或“不”)
③混合气体的颜色应变______________(填“深”、“浅”或“不变”)
④混合气体平均相对分子质量_______化学平衡常数将_____(填“增大”、“减小”或“不变”)
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol·Lˉ1。反应进行2min后A的浓度为0.8 mol·Lˉ1,B的浓度为0.6 mol·Lˉ1,C的浓度为0.6 mol·Lˉ1。则2min内反应的平均速率VA=__________,VB=_____________,VC=___________。该反应的化学反应方程式为___________________________。
将32gCu与一定浓度的硝酸混合,二者正好完全反应。产生的NO2、NO混合气体在标准状况下的体积为11.2 L。
(1)分别写出Cu和HNO3反应过程的化学方程式:
,
(2)反应过程中被还原的硝酸的物质的量是mol
下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,金属性最强的主族元素是 (用元素符号表示,下同),非金属性最强的是,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 >
(用化学式表示)
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为:。从装置的设计看,确定E中空气已被赶尽的实验现象是:______________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明?
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是
。
(4)装置D的作用是。