(本题共16分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 |
物理性质描述 |
化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 |
白色无定形粉末或白色至淡绿色六方晶体 |
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 |
白色沉淀 |
此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 |
白色 |
能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: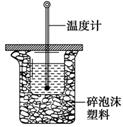
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: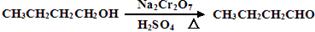 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/g·cm-3 |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将Na2Cr2O7溶液与浓硫酸混合液放置在B中。在A中加入正丁醇和几粒沸石,加热,保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,除去水层,有机层干燥后蒸馏,收集75~77℃馏分。
回答下列问题: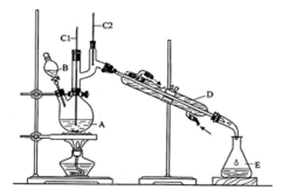
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)上述装置图中,B仪器的名称是,D仪器的名称是。
(3)温度计的作用分别是C1;C2。
(4)将正丁醛粗产品置于分液漏斗中水在层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是。
某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。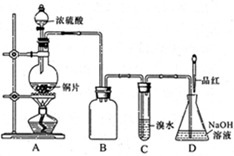
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 |
实验操作 |
现象 |
反应的可能情况 |
| ① |
滴加少量淀粉碘化钾溶液,振荡 |
III |
|
| ② |
滴加少量棕红色的KI3溶液,振荡 |
II |
|
| ③ |
滴入加少量酸性KMNO4溶液,振荡 |
溶液呈紫色 |
|
| ④ |
加入几小块CaCO3固体 |
有气泡产生 |
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验的方案即可),证明镁元素的金属性比铝元素强。
试剂:镁条、铝条、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液
方案一:_____________________________________________________________;
方案二:_____________________________________________________________。
Ⅱ.利用下图装置可验证同周期元素非金属性的变化规律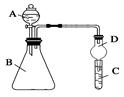
(1)仪器A的名称为________,干燥管D的作用为________________。
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加___________,观察到C中溶液___________________________的现象,即可证明。反应的离子方程式为________________________________________________________。
从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:N>C,则在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。该实验原理为______________________________。但有的同学在实验中一切操作正确的情况下没观察到上述现像,试分析可能的原因是___________________________。
某实验小组用下列装置进行乙醇催化氧化的实验。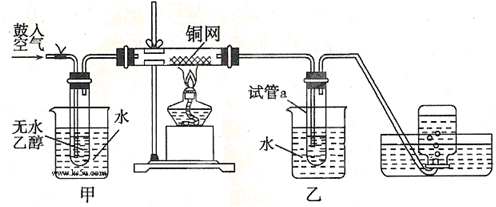
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是 ______反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
(3)反应一段时间后,试管a中能收集到不同的物质,它们可能是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可先在混合液中加入 (填写字母),然后,再通过(填试验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳