500℃时,将SO2和O2置于一容积固定为2 L的密闭容器中发生反应。反应过
程中SO2、O2和SO3物质的量变化如图所示,请回答下列问题:(1)反应10 min至15 min,
O2的平均反应速率为 mol·(L·min)-1,比反应开始时前10 min速率 ,可能的原
因是 。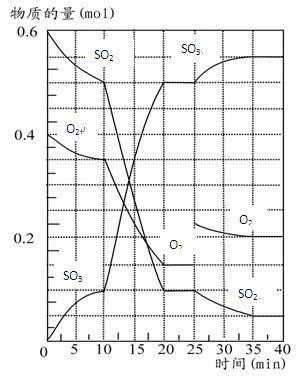
(2)从曲线变化可以看出,反应进行至25min时,采取了 使得平衡向
方向移动,达到新平衡后SO2的体积分数比原平衡小。
已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是__________________。
(2)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是__ mol·L-1。
(3)用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处__________________(填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器是__________________。
(1)下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为 。
填空
(1)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。A与溴的四氯化碳溶液反应的化学方程式为 。
(2)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。A与氢气完全加成后产物的一氯代物共有 种。
(3)如图所示装置
用乙醇、乙酸和浓硫酸制取乙酸乙酯的化学方程式为___________。右侧小试管中所加的试剂为____ ___,装置中干燥管的作用是_______________。
现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是____ ____。
A.c(H+)B.c(H+)/ c(CH3COOH)C.c(H+)·c(OH-)D.c(OH-)/ c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两种溶液,各稀释100倍。稀释后的溶液,其pH大小关系应为:
pH(甲)_ __pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K1 |
1.8×10-5 |
4.3×10-7 |
3.0×10-8 |
| K2 |
—— |
5.6×10-11 |
—— |
下列四种离子结合H+能力最强的是______________。
A.HCO3-B.CO32-C.ClO-D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):______________________;
HClO+Na2CO3(少量):______________________。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g)K1
2C(s)+O2(g)=2CO(g)K2
C(s)+ H2O(g)=CO(g)+ H2(g)K=____ ___(用含K1、K2的式子表示)。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化为
①已知气缸中生成NO的反应为:N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H 0
0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)。已知该反应的△H 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。