实验室需要用240mL 0.1mol/L稀盐酸,现用密度为1.18g/mL,质量分数为36.5%浓盐酸配制,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积 mL ,应选用容量瓶的规格 mL。 除容量瓶外还需要的其它仪器
。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作 ;b.加蒸馏水时不慎超过了刻度 ;c.定容时俯视 。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度 ? 。
(2014届辽宁省东北三省高三第二次模拟考试理综化学试卷)
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。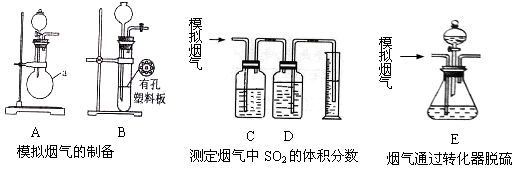
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为 。
(2)用B装置制CO2,使用该装置优点的是 。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是 、 。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是 。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+② 。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经 、洗涤、 、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是 。
BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。
(2)计算BaCl2·xH2O中的x= (要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有 。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是 。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是 。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离? (填“能”或“不能”),理由是 。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”、“偏小”或“不变”)。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: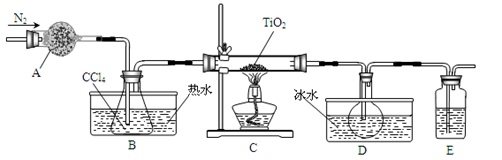
有关物质性质如下表
| 物质 |
熔点/℃ |
沸点/℃ |
其他 |
| CCl4 |
-23 |
76 |
与TiCl4互溶 |
| TiCl4 |
-25 |
136 |
遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq)
简要工艺流程如下: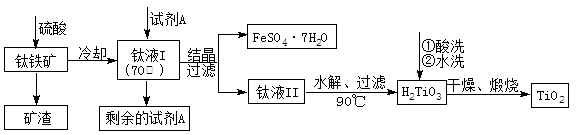
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。