已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)  +Xn
+Xn ——X单质
——X单质 未配平); (乙
未配平); (乙 mOH-===M(OH)m
mOH-===M(OH)m
①若n=1,则 中X元素为+5价,X位于周期表第ⅤA族
中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧 溶液一定能得到
溶液一定能得到
⑤若m=3,则 与足量氢氧化钠溶液反应一定生成M(OH)m
与足量氢氧化钠溶液反应一定生成M(OH)m
| A.①③ | B.④⑤ | C.①② | D.②③ |
把mmol C2H4跟nmol H2 混合在密闭容器中,在适当条件下,反应达到平衡时生成pmolC2H6,若将所得平衡混和气体完全燃烧生成二氧化碳和水,需要氧气的量是
A (3m+n)molB (3m+n/2)mol
C (3m+3p+n/2)mol D (3m+n/2-3p)mol
除去下列各物质中的少量杂质,括号内的试剂和操作正确的是

| A.丙烷中的丙烯(H2 加热) | B.乙醇中的水(无水CuSO4,蒸馏) |
| C.苯中的二甲苯(Br2水,分液) | D.甲苯中的苯酚(NaOH溶液,分液) |
芳香化合物A、B互为同分异构体,B的结构简式是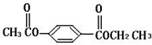 。
。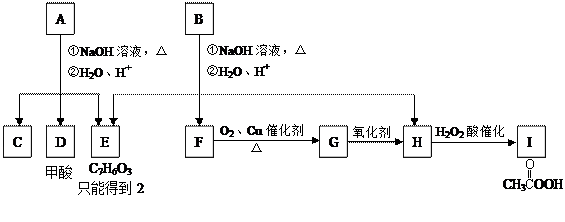
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
(提示:CH3COO-
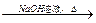 CH3COONa+
CH3COONa+ -ONa)
-ONa)
(1)写出E的结构简式。
(2)A有2种可能的结构,写出相应的结构简式。
(3)F和小粒金属钠反应的化学方程式是,实验现象是,反应类型是。
(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:,实验现象是,反应类型是。
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式,实验现象是,反应类型是。
(6)在B、C、D、F、G、I化合物中,互为同系物的是。
有下列一系列稠环化合物: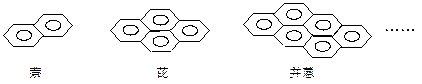
从萘开始,这一系列化合物中第25个的分子式为()


| A.C150H50 | B.C154H50 | C.C154H 56 | D.C150H56 |
现有一瓶乙二醇和丙三醇的混和物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是
| 物质 |
分子式 |
熔点℃ |
沸点℃ |
密度(g/cm3) |
溶解性 |
| 乙二醇 |
C2H6O2 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 |
C3H8O3 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
A萃取法 B结晶法 C分液法 D分馏法
