探究实验报告一:蜡烛及其燃烧的探究
探究实验的名称:蜡烛及其燃烧的探究
探究实验的目的:理解掌握蜡烛的有关性质知识
实验用品:蜡烛、火柴、 等
| 步骤和方法 |
现象 |
分析 |
|
| 点燃前 |
|
蜡烛是白色蜡状固体,硬度小,稍有气味 |
|
| 用小刀切下一小块蜡烛投入水中 |
石蜡浮于水面 |
|
|
| 点燃蜡烛 |
|
蜡烛先熔化后气化,再燃烧;火焰明亮且明显分成三层 |
|
| 在烛焰上方罩一干燥烧杯 |
烧杯内壁出现水雾或水珠 |
|
|
| 在烛焰上方罩一个内壁沾有澄清石灰水的烧杯,振荡 |
烧杯内壁出现白色斑点 |
|
|
| 熄灭蜡烛 |
火焰熄灭,灯芯上产生一缕轻烟 |
轻烟为蜡烛蒸气冷却所致,遇明火可以燃烧。 |
结论:在通常情况下,蜡烛是白色蜡状固体,稍有气味,熔点、熔点较低,硬度较小,密度比水小。蜡烛在点燃条件下能燃烧,燃烧产物中有水和二氧化碳等。
问题和建议:为进一步说明蜡烛是先气化,然后是石蜡蒸气燃烧,可用一根尖嘴的细玻璃管插入焰心,然后在尖嘴处点燃。根据是否能点燃,可推断上述猜测是否正确。
某校化学研究性学习小组的同学对一包因敞口放置已部分变质的氢氧化钠固体产生了兴趣,老师安排第一小组做除去NaOH溶液中Na2CO3的实验。第二小组同学做测定该混合物中NaOH质量分数的实验。请你参与他们的探究过程。
【知识准备】(1)氢氧化钠不能敞口放置的原因是:因为空气有___________;
(2)判断氢氧化钠是否变质的方法之一是向样品中加盐酸,加入过量盐酸后看是否有气体生成,写出产生气体的反应化学方程式:________________;
(3)判断氢氧化钠是否变质的另一种方法是将样品溶于水,再向样品中加澄清石灰水,看是否变浑浊,写出产生沉淀的反应化学方程式是:________________.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验。其中合理的是___。
甲:适量稀盐酸
乙:过量KOH溶液
丙:适量Ca(OH)2溶液
丁:适量CaCl 2溶液。
Ⅱ、第二小组的同学讨论测定该固体混合物中NaOH质量分数的方案
【提出问题】样品中氢氧化钠的质量分数是多少?
【设计方案】小明同学:同学称取10g样品,加水配成溶液,在溶液中加入少量氯化钙。过滤、洗涤、干燥,共得到白色沉淀0.1g。“能否用小明同学实验所得的数据计算出样品中氢氧化钠的质量分数?”,小刚思考后,觉得不妥,理由是:____________。
【解决问题】小刚和小明同学决定重新设计方案:称取8g样品配成溶液,向其中滴加5.11%的稀盐酸,直至无气泡放出,刚好用去稀盐酸100g,测出二氧化碳气体体积,换算出二氧化碳质量为0.88g。
①求:8g样品中碳酸钠的质量?(有情提醒:操作和换算均正确)
②计算氢氧化钠的质量分数:小明没有用到盐酸的质量,计算结果为 73.5%;小刚利用了盐酸的质量,计算结果为 50%。你支持谁的计算方法,并说明理由:。
将一定量的碳酸钠溶液与氯化钡溶液混合,过滤反应后的混合物。某研究小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
【查阅资料】碳酸钠溶液显碱性;氯化钠、氯化钡溶液显中性。
请你写出碳酸钠溶液与氯化钡溶液反应的化学方程式。
【提出猜想】
猜想1:滤液中溶质是NaCl;
猜想2:滤液中溶质是NaCl和(填化学式)的混合物;
猜想3:滤液中溶质是NaCl和Na2 CO3的混合物。
【实验探究】
(1)取少量滤液于试管中,滴加几滴无色酚酞试液,振荡,无明显现象。同学们认为猜想不成立。
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有(填实验现象)证明猜想2成立。
【问题讨论】
(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液。你认为甲同学(填“能”或“不能”)达到实验目的。
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液。你认为乙同学(“能”或“不能”)达到实验目的。
(共7分)在化学兴趣小组活动中,小华把一标有“生石灰干燥剂”的小纸袋带到学校进行实验。干燥剂是否变质?小华与小冬设计并进行了如下实验,请你帮他们完成实验报告。
(1)小华设计实验步骤是:取少量干燥剂放入试管中,加入少量,观察到的实验现象是:,得出结论是:干燥剂中含有CaO;
小冬设计实验步骤是:取少量干燥剂制得的溶液于试管中,滴入几滴酚酞试液,观察到的实验现象是:,得出结论是干燥剂中含有Ca(OH)2。
(2)小明认为小冬的实验不科学,理由是_______________________________。
(3)既然干燥剂中已有Ca(OH)2,小华又猜想还可能有另一种物质生成,原因是_______________(用化学方程式表示)。请你设计实验证明小华的猜想(简要写出实验步骤、现象及结论)_____________。
小明用下图A所示装置测定空气中氧气的含量.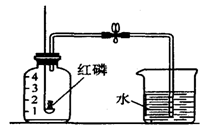
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是_________,该反应的符号表达式为_______ _____.
(2)小明又设计了如下图所示的改进装置, 其中A是底面积为50 cm3、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度.B是带刻度的敞口玻璃管(其他辅助装置略)。他们的操作过程如下:
a.检查装置的气密性;
b.加入水并调整B的高度.使A中的液面至刻度15 cm处;
c.将过量的红磷平铺在惰性电热板上。盖紧密封盖;
d.通电加热红磷,待充分反应后.冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。(注:A容器内固态物质所占的体积忽略不计)
①在操作a中检查装置气密性的方法是。
②在操作d结束时,装置A 中液面的刻度约为cm(填整数)。如果在操作d结束时,装置A中液面刻度在11cm处.则实验结果比理论值(填“偏大”或“偏小”)。
③改进后的装置的优点是______________.
化学是一门实验科学。我们可以通过观察肉眼可见的实验现象,再加上分析推理,来认识分子的性质和确认分子的真实存在。
【实验理解】
(1)用如图所示的装置进行实验:在大烧杯罩住的两个小烧杯中,分别盛有。
A.浓氨水和酚酞溶液
B.酚酞溶液和酚酞溶液
C.浓氨水和浓氨水
(2)本实验用到对照的方法,起对照作用的是不变色和变色。
(3)实验中可以直接观察到的项目是
A.氨分子的质量和体积都很小
B.氨分子在不断运动
C.氨分子之间有间隔
D.A烧杯和B烧杯内的溶液都变红
E.A烧杯内的溶液变红
【实验延伸】
某同学对浓氨水使酚酞溶液变红的速度发生了浓厚的兴趣,并设计了以下探究实验:
①制备“标准色”溶液:取浓度为20%的5mL浓氨水、20mL酚酞溶液注入小烧杯,并给小烧杯蒙上塑料薄膜。
②另取适量药品用一只大烧杯和两只小烧杯仿照上图进行实验,观察并测定酚酞溶液变成“标准色”所需的时间。
【问题探究】
(4)给“标准色”溶液的小烧杯蒙上薄膜的作用是。
(5)想尽快使酚酞溶液变成“标准色”的方法有多种,一种方法是,还有一种方法是。