(10分))对于A+2B(气) nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
某酯K是一种具有特殊香气的食用香料,广泛应用于食品和医疗中。其合成路线如下: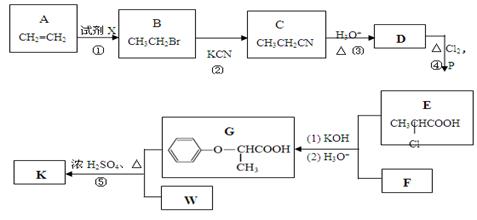
已知: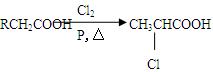
(1)E的含氧官能团名称是 。
(2)试剂X是 (填化学式);②的反应类型是 。
(3)D的电离方程式是 。
(4)F的分子式为C6H6O,其结构简式是 。
(5)W的相对分子质量为58,1 mol W完全燃烧可产生3.0 mol CO2和3.0 mol H2O,且
W的分子中不含甲基,为链状结构。⑤的化学方程式是 。
(6)G有多种属于酯的同分异构体,请写出同时满足下列条件的所有同分异构体的结构简式: 。
① 能发生银镜反应且能与饱和溴水反应生成白色沉淀
② 苯环上只有两个取代基且苯环上的一硝基取代物只有两种
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。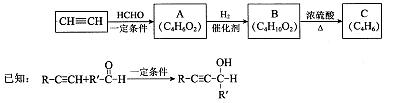
(1)A分子中的官能团名称是 、 。
(2)A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ,其反应类型是 。
II.用烃C或苯合成PMLA的路线如下。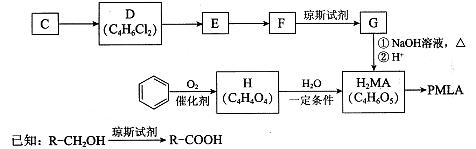
(4)1 mol有机物H与足量NaHC03溶液反应生成标准状况下的C02 44.8L,H有顺反异构,其反式结构简式是 。
(5)E的结构简式是 。
(6)G与NaOH溶液在加热条件下反应的化学方程式是 。
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种) 。
化合物G的合成路线如下: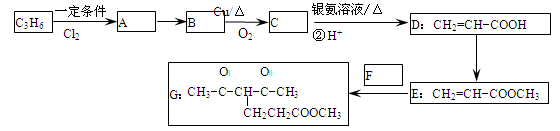
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2
(2)除掉E中含有少量D的试剂和操作是 ;下列有关E的说法正确的是 (填字母序号)。
| A.可发生氧化反应 |
| B.催化条件下可发生缩聚反应 |
| C.可发生取代反应 |
| D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式 。
(4)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。
(5)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):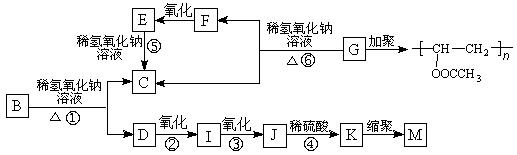
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②-ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,该官能团的名称是 。
(2)上述变化中属于水解反应的是 (填反应编号)。
(3)写出结构简式,G: ,M: 。
(4)写出反应①的化学方程式: 。
(5)任写一种符合下列要求的A的同分异构体 。
I.含有苯环 II.能发生银镜反应,且能使氯化铁溶液显紫色
III.苯环上的一元取代物只有一种
已知A是生产某新型工程塑料的基础原料之一,合成A的路线如下图所示。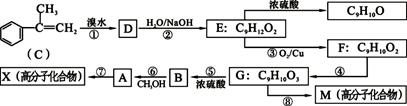
(1)与C分子式相同的一种物质化学名称叫:4-甲基苯乙烯,写出其结构简式_____。
(2)反应⑦为加聚反应,⑤的反应类型为______,写出A的结构简式为______,F的含氧官能团名称______。
(3)写出反应⑧的化学方程式______。
(4)A有多种同分异构体,符合下列条件的同分异构体有____种。
①分子中有6个碳原子在一条直线上②苯环上的一硝基取代物只有1种
③分子的核磁共振氢谱有4个吸收峰
写出其中一种与碳酸钠溶液反应的化学方程式:______。