已知A是生产某新型工程塑料的基础原料之一,合成A的路线如下图所示。
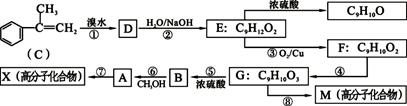
(1)与C分子式相同的一种物质化学名称叫:4-甲基苯乙烯,写出其结构简式_____。
(2)反应⑦为加聚反应,⑤的反应类型为______,写出A的结构简式为______,F的含氧官能团名称______。
(3)写出反应⑧的化学方程式______。
(4)A有多种同分异构体,符合下列条件的同分异构体有____种。
①分子中有6个碳原子在一条直线上 ②苯环上的一硝基取代物只有1种
③分子的核磁共振氢谱有4个吸收峰
写出其中一种与碳酸钠溶液反应的化学方程式:______。
酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如图所示,则下列有关说法正确的是(双选)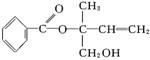
| A.X在一定条件下能发生加成反应、加聚反应和取代反应 |
| B.在Ni催化下,1 mol X最多只能与1 mol H2加成 |
| C.可用酸性高锰酸钾溶液区分苯和X |
| D.X核磁共振氢谱有10个吸收峰 |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得: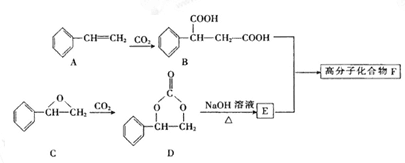
化合物B分子式为,1mol化合物B完全燃烧需要消耗mol O2 。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,但只有Ⅰ能与Na反应产生H2,则化合物Ⅰ的结构简式为(任写一种);由化合物Ⅱ生成A的反应条件为。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式:。
(5)化合物Ⅲ的结构简式为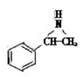 在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:。
在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:。
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
试判断该反应为反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式: Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),原因是。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),原因是。
(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
试回答:
①电源a极的名称是。
②写出阴极电极反应式。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是。
工业制硝酸经以下一系列反应: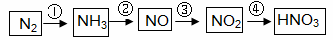
请回答:
(1)写出反应④的化学方程式,实验室收集NO的方法是。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母)。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H=kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: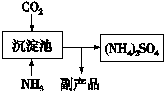
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析)。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)表中字母a元素在周期表中位置。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型。
(3)表内短周期元素形成的物质W、X、Y、Z,存在下列转化关系
其中X为表中字母c元素的最高价含氧酸浓溶液;Y能使品红溶液褪色;W为表中字母a元素形成的常见气体。
①反应I的化学方程式为;反应I的溶液中有一种白色固体析出,为了证明该物质常采用的实验方法为。
②反应Ⅱ的化学方程式为;写出一种提高Y转化率的方法。
③常温下d遇浓硫酸形成致密氧化物薄膜,若薄膜为Fe3O4,写出该反应的化学方程式。
(12分)下列有机化合物转化关系如图所示: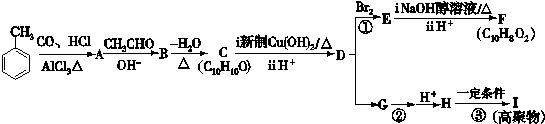
已知:
(1)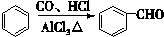
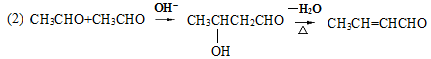
其中化合物A苯环上的一氯代物只有两种。
请回答下列问题:
(1)写出A的结构简式。
(2)B中含有的官能团的名称。
(3)①的反应类型为;化合物F的核磁共振氢谱显示有个峰。
(4)写出C与新制Cu(OH)2反应的化学方程式。
(5)已知两分子H能形成六元环酯,写出反应②的条件;反应③的化学方程式。
(6)化合物C有多种同分异构体,请写出其中满足下列条件的所有同分异构体的结构简式。
①遇氯化铁溶液显紫色;
②苯环上有三个取代基;
③苯环上的一氯取代物只有两种。