近年来,太湖蓝藻暴发,造成无锡市自来水水源地水质严重恶化。这再次敲响了我国水危机的警钟。太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、CO32-、SO42-。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是__________,肯定没有的离子是__________,可能含有的离子是________。
(2)如何通过实验进一步确定溶液中可能存在的离子?
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: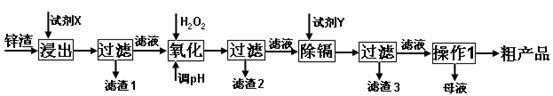
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为(填名称)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是(填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)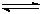 CH3OH(g)。图1表
CH3OH(g)。图1表 示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。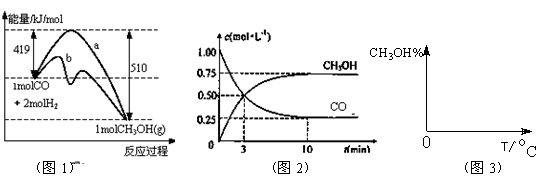
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于(填:吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡, v(H2)=____ ____;该温度下CO(g)+2H2(g) 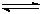 CH3OH(g)的化学平衡常数为______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
(16分)从樟科植物枝叶提取的精油中含有甲、乙两种成分:
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):
反应I的反应类型为,Y的结构简式。
(3) 1mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式。
(14分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。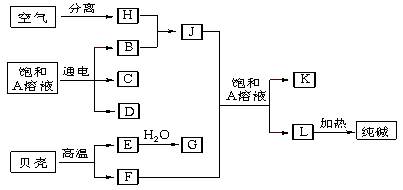
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式:。
(2) 电解A溶液反应的离子方程式为___________________________________。
若该反应中转移电子数为8NA,则产生的氯气 在标准状况下体积为L
在标准状况下体积为L
(3) J分子的空间构型为____________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:____________________。
(12分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO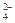 、NO3-、OH- 、NO3-、OH- |
现进行以下实验,
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲乙
(2)丙的阴离子的电子式是,丁的阳离子的结构示意图是;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合: