在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 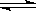 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡的时间是 ,理由是 。
(2)右图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。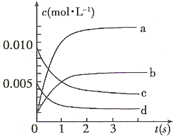
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2) d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
除去下列物质中的杂质(括号内为杂质),试选用合适的试剂进行填空。(填写字母序号)
选择的试剂:
| A.盐酸 | B.水 | C.饱和食盐水 | D.AgNO3溶液 E.NaOH溶液 |
F.氯水 G.硫酸铜溶液 H.硫酸溶液 I.铁 J.CO2
(1)FeCl3溶液(FeCl2)________,
(2)NaHCO3溶液(Na2CO3) ,
(3)NaNO3溶液(NaBr)________,
(4)SiO2(CaCO3固体) ,
(5)Mg(Al)________________
按要求回答下列问题:
(1) 的系统命名为 ;
的系统命名为 ;
(2)3甲基2戊烯的结构简式为 ;
(3) 的分子式为 ;
的分子式为 ;
(4)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①试写出它的一种链式结构的同分异构体的结构简式_______________________。
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为________________________形。
观察下列结构简式,回答下列问题:
Ⅰ、乙酸的结构简式为
(1)a的名称是__________。
(2)c的名称是________________。
Ⅱ、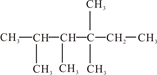
(1)有机物名称是__________________________。
(2)此有机物为烯烃加成的产物,则原来烯烃的结构可能有_______种。
写出下列化合物的名称或结构简式:
(1)结构简式为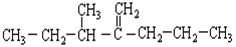 此烃名称为 。
此烃名称为 。
(2)结构简式为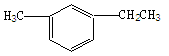 的烃可命名为 。
的烃可命名为 。 (3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为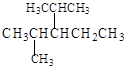 的烃可命名为: 。
的烃可命名为: 。
(6分)写出下列有机物的系统命名或结构简式
(1)2,2-二甲基-3-乙基己烷 ;
(2)CH3CH(CH3)C(CH3)2CH2CH3 ;
(3)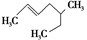 。
。