由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32—、SO42—。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是_____ ___。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
(3)试确定K+是否存在?________,判断的理由是_____________________________________________ __。
下表所列是元素周期表部分短周期的主族元素
| W |
X |
Y |
||
| R |
Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l)△H1=—195kJ•mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g)△H2=—534.2kJ•mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)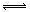 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线: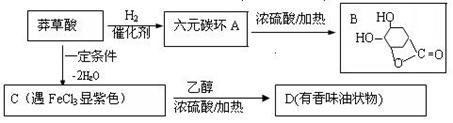
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为。
(3)莽草酸→C的反应类型是。
(4)写出C→D的化学反应方程式。
(5)与C具有相同官能团的同分异构体(含C)共有种。
(1)铬的外围电子排布式是,与铬同周期,最外层有3个未成对电子数的主族元素名称是,该元素对应的最低价氢化物分子的中心原子采取了杂化方式,分子的空间构型是 。
(2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为______ 。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:。
(3)氟化氢水溶液中存在氢键有种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是,锰与X在准晶体中的结合力为。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是(填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式:。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□+□KNO2+□。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂,滴定终点观察到的现象。
②溶液I中铁元素的总含量为g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会(填“偏高”、“偏低”、“不变”)。
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图:。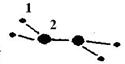
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是(用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为。
| T/K |
303 |
313 |
323 |
| NH3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) 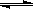 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq)
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① |
等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 |
生成白色沉淀 |
| 实验② |
等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 |
无现象 |
请分析实验①、②产生不同现象的原因:。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 |
I—的初始浓度 (mol·L—1) |
ClO—的初始浓度 (mol·L—1) |
OH—的初始浓度 (mol·L—1) |
初始速率v (mol·L—1· s—1) |
| 1 |
2 × 10—3 |
1.5 × 10—3 |
1.00 |
1.8 × 10—4 |
| 2 |
a |
1.5 × 10—3 |
1.00 |
3.6 × 10—4 |
| 3 |
2 × 10—3 |
3 × 10—3 |
2.00 |
1.8 × 10—4 |
| 4 |
4 × 10—3 |
3 × 10—3 |
1.00 |
7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v=。