现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: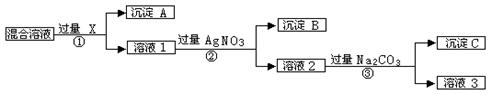
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X _______,沉淀A:_______,沉淀B:__________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
⑶按此实验方案得到的溶液3中肯定含有_____________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_________,之后若要获得固体NaNO3需进行的实验操作是___________________ (填操作名称).
下图A是实验室用石灰石和稀盐酸制取CO2的常用装置。请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体。
(1)a和b的仪器名称分别是、。
(2)检验D中气体是否收集满了的操作是:_________________________________。
(3)B中装入一定量的饱和NaHCO3目的除去A挥发的HCl反应的方程式
(4)C中装入干燥剂除去水蒸气,可选择干燥剂是
a浓硫酸 b烧碱 c无水氯化钙 d碱石灰
实验室用NaOH固体配制250 mL 1.25 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250 mL 1.25 mol/L的NaOH溶液
| 应称取NaOH的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它玻璃仪器 |
(2)容量瓶上需标有以下五项中的;
①温度②浓度③容量④压强⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30 mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是,溶液注入容量瓶前需恢复到室温,这是因为_____________________________;
(5)下列配制的溶液浓度偏低的是;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是____________________________________;
写出选用物质的名称:A____________,B__________,C____________;
(2)上述反应的离子方程式分别为______________; _________________;
(3)乙同学的实验原理是_________________________________。
写出B处的离子方程式: __________________________________。
碘在科研与生活中有重要作用,某兴趣小组用0.50 mol·L—1KI、0.2%淀粉溶液、0.20 mol·L—1K2S2O8、0.10 mol·L—1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O82—+ 2I— =" 2" SO42— + I2(慢) I2 + 2 S2O32— = 2I— + S4O62—(快(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为:n(S2O32—):n(S2O82—)。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx = ml,理由是。
(3)已知某条件下,浓度c(S2O82—)随反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)随反应时间t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起搏器电源—锂碘电池的材料,
该电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s)ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s)ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2
则电池反应的ΔH = ;还原剂是。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请从下表中实验现象(II)(填A、B、C……)中选出与实验方案(I)(填1、2、3……)对应的实验现象,填入答案(III)中。
| 实验方案(I) |
实验现象(II) |
答案(III) |
|
| I |
II |
||
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 |
A.浮与水面,剧烈反应,放出气体,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色。 |
1 |
|
| 2.向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
2 |
|
| 3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
3 |
|
| 4.镁带与2mol/L的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
4 |
|
| 5.铝条与2mol/L的盐酸反应 |
E.生成白色絮状沉淀,继而沉淀消失 |
5 |
|
| 6.向AlCl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
6 |
|
通过以上实验分析了同周期的哪些元素(填元素符号)________________,从实验结果可以得出的结论是______________________________________。