已知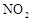 和
和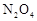 可以相互转化:
可以相互转化: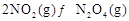 △H<0。现将一定量
△H<0。现将一定量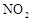 和
和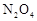 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。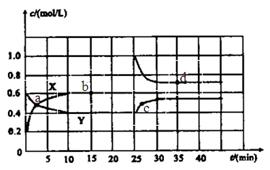
(1)图中共有两条曲线X和Y,其中曲线________表示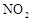 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收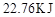 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。
(2)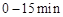 ,反应
,反应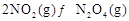 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在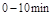 时平均反应速率
时平均反应速率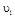 与
与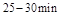 时平均反应速率
时平均反应速率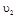 的大小__________。
的大小__________。
(3)反应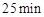 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
(4)若要达到使 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在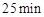 时还可以采取的措施是___________。
时还可以采取的措施是___________。
| A.加入催化剂 | B.缩小容器体积 | C.升高温度 | D.加入一定量的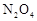 |
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是:。电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为,
则肼-空气燃料电池理论上消耗的空气L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为。
(1)现有反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向 方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是_______________________,
阳极是_________________________,
电解总的反应方程式是_________________________。
(1)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
(2)已知:① C(s)+O2(g)=CO2(g);DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g);DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH=。
在烷烃分子中的基团:-CH3、-CH2-、 、
、 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如: 分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
(1)烷烃分子中氢原子数n0与n1、n2、n3、n4之间的关系是n0=_________________。
(2)四种碳原子数之间的关系为n1=_________________________________________。
(3)若分子中n2=n3=n4=1,则该分子的结构简式可能为(任写一种)________________。