下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为________mol/L。
某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:
(2)该学生需要量取________ mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)
、 。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次) __________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1—2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是________
A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
(11分)为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮。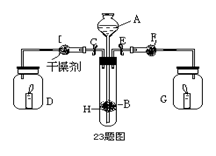
(1)请判断各仪器中盛放的物质的化学式:
A; B;F。
(2)用化学反应方程式表示上述有关反应(不包括蜡烛的燃烧):
,
,
.
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。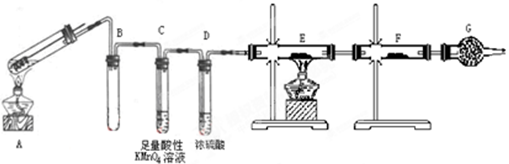
(1)填写装置的作用:
B ,
C,
G。
(2)先点燃处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作。
(3)证明有SO2生成的现象是。
(4)可以证明气体X中含有氢气的实验现象是:________________________。
如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是____________________。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量(填“相等”、“不相等”),若实验操作均正确,则所求中和热填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ、⑴按照甲同学的观点,发生反应的离子反应方程式为______________________;
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是。
Ⅱ、请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为_________→_________→___________。
(2)能证明生成物中有CuCO3的实验现象是_____________________________________。
Ⅲ、若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
(1)装置C中碱石灰的作用是_________________________________________。
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为__________。
(13分) 用如右图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究。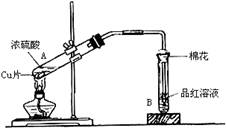
(1)写出试管B中的实验现象。
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目:。
(3)充分反应后,该学生发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种不是酸类的物质)。
(4)B试管口的棉花应沾有的试剂是,其作用是,离子方程式为。