A、B、C、D分别是HCl、BaCl2、AgNO3、Na2CO3 四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
A+B |
C+D |
A+D |
A+C |
B+D |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
由上述现象可推知A、B、C、D的化学式为:A________________ B________________ C________________ D________________
(10分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题: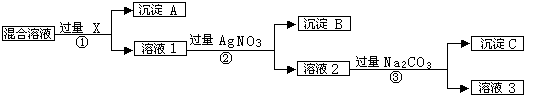
(1)写出实验流程中下列物质化学式:试剂X,沉淀A,沉淀B。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为:、、。
(3)上述实验流程中加入过量的Na2CO3的目的是。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
用方程式表示下列反应的原理(是离子反应的写离子方程式):
(1)除去碳酸钠固体中混有的少量碳酸氢钠:。
(2)除去FeCl2溶液中的少量FeCl3:。
(3)实验室用硫酸铝溶液与氨水制备氢氧化铝:。
(4)除去Mg粉中混有的少量Al粉:。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?______(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是____________。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+) - c(A-)= ____________mol·L-1;
c(OH-) -c(HA)= ____________mol·L-1。
密闭容器中mA(g)+nB(g)  pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如图。
则:(1)增大压强:A的转化率,平衡向 移动,达到平衡后,混合物中C的质量分数_____。
(2)上述化学方程式中的系数m、n、p的正确关系是。
(3)降低温度,C的质量分数增大,则:平衡向 移动,A的转化率,正反应是 热反应。(以上各空用适当的化学用语或关系式填写)
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中H2CO3____ CO32-(填>、=或<),原因________________________(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)="________"
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度为mol·L-1