在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是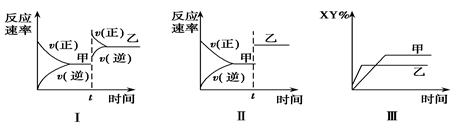
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ是一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ一定是升高温度的变化情况 |
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是()
| A.一定有甲烷 | B.一定有乙烯 | C.一定没有甲烷 | D.一定有乙烷 |
下面有关丙烷、丙烯、丙炔说法中正确的有()
A.丙烷、丙烯、丙炔的结构简式分别为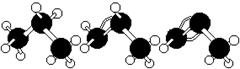 |
| B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1 |
| C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相对密度不断增大 |
| D.丙烷的碳原子空间结构是锯齿型的,不是简单的直线排列 |
能用酸性高锰酸钾溶液鉴别的一组物质是()
| A.乙烯、乙炔 | B.苯、己烷 |
| C.苯、甲苯 | D.己烷、环己烷 |
(CH3CH2)2CHCH3的正确命名是( )
| A.3-甲基戊烷 | B.2-甲基戊烷 | C.2-乙基丁烷 | D.3-乙基丁烷 |
下列物质属于醇类的是()
A.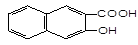 |
B.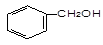 |
C.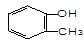 |
D.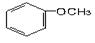 |