以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
有一定质量的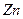 与
与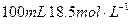 的浓
的浓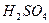 充分反应,
充分反应,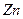 完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中
完全溶解,同时生成标准状况下的气体A33.6L,将反应后的溶液稀释到1L,测得溶液中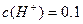

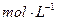 。则气体A中各组分的体积比为
。则气体A中各组分的体积比为
臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是:,这个反应的氧化产物是,还原产物是。
针对以下A~D四个涉及H2O2的反应(未配平),填写空白
A.Na2O2+HCl——H2O2+NaCl |
B.Ag2O+H2O2——Ag+O2+H2O |
C.H2O2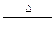 H2O+O2 H2O+O2 |
D.H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O |
 (1)H2O2仅体现氧化性的反应是(填代号)。
(1)H2O2仅体现氧化性的反应是(填代号)。 (2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。 (3)H2O2体现弱酸性的反应是(填代号),其理由为。
(3)H2O2体现弱酸性的反应是(填代号),其理由为。
根据硫化氢气体的实验室制法和性质完成下列填空。
 (1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用()。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用()。

| A. |
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁 |

 (2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图中选择合适的仪器;
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图中选择合适的仪器;
 (填编号)。
(填编号)。



(3)如图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
 的现象是。
的现象是。


 (4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
 反应过程中,溶液的
(填"变大"、"变小"或"不变")。
反应过程中,溶液的
(填"变大"、"变小"或"不变")。
 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。如图的装置能起到此作用的是。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。如图的装置能起到此作用的是。



 (6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是。
(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是。
将一定量的
和含0.7
氧气的空气(忽略
)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:
 (正反应放热)。反应达到平衡后,将容器中的混合气体通过过量
溶液,气体体积减少了21.28
;再将剩余气体通过焦性没食子酸的碱性溶液吸收
,气体的体积又减少了5.6
(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量
溶液,气体体积减少了21.28
;再将剩余气体通过焦性没食子酸的碱性溶液吸收
,气体的体积又减少了5.6
(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
请回答下列问题:



 (1)判断该反应达到平衡状态的标志是。(填字母)
(1)判断该反应达到平衡状态的标志是。(填字母) a.
和
浓度相等b.
百分含量保持不变
a.
和
浓度相等b.
百分含量保持不变 c.容器中气体的压强不变 d.
的生成速率与
的消耗速率相等
c.容器中气体的压强不变 d.
的生成速率与
的消耗速率相等 e.容器中混合气体的密度保持不变
e.容器中混合气体的密度保持不变 (2)欲提高
的转化率,下列措施可行的是(填字母)
(2)欲提高
的转化率,下列措施可行的是(填字母) a.向装置中再充入
b.向装置中再充入
a.向装置中再充入
b.向装置中再充入

c.改变反应的催化剂 d.生高温度 (3)求该反应达到平衡时
的转化率(用百分数表示)。
(3)求该反应达到平衡时
的转化率(用百分数表示)。 (4)若将平衡混合气体的5%通入过量的
溶液,生成沉淀多少克?
(4)若将平衡混合气体的5%通入过量的
溶液,生成沉淀多少克?