某实验小组用下列装置进行乙醇催化氧化的实验。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。
⑵甲和乙两个水浴作用不相同。
甲的作用是 ;乙的作用是 。
⑶反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 、 、
。集气瓶中收集到的气体的主要成分是 。
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可得到乙醛。
⑸图中丙处导管应倾斜的原因是 。
⑹本实验中若不鼓入空气,其他操作不变,乙处试管内也得到了乙醛,则发生的化学方程式为 。
分硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)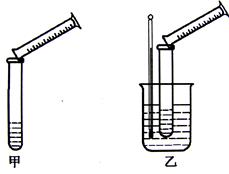
(1)实验目的:
装置甲,探究浓度对化学反应速率的影响;装置乙,探究对化学反应速率的影响。
(2)装置乙中的加热方法称为加热,该加热方法具有 、
等优点。
(3)通过甲、乙装置,分别进行了四组实验,数据记录如下,并经分析得出相关结论:
| 实验组号 |
温度 |
Na2S2O3 |
H2SO4 |
加入H2O 的体积 |
出现沉淀 所需时间 |
||
| 体积 |
浓度 |
体积 |
浓度 |
||||
| Ⅰ |
0OC |
5mL |
0.1mol/L |
10mL |
0.1mol/L |
5mL |
8s |
| Ⅱ |
0OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
12s |
| Ⅲ |
30OC |
5mL |
0.1mol/L |
5mL |
0.1mol/L |
10mL |
4s |
| Ⅳ |
30OC |
5mL |
0.2mol/L |
5mL |
0.2mol/L |
10mL |
2s |
结论1:;
结论2:。
分实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35mol冰醋酸,再加入4mL浓H2SO4至不再分层。②在烧瓶上安装冷凝回流装置,加热混合物1h后,冷却至室温。③把混合物转至分液漏斗中,加入少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。④用5%的NaHCO3溶液分几次洗涤产品直至中性。⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2,蒸馏,收集135-143℃之间的馏分。
试回答下列问题:
(1)冷凝管中冷却水的流向是由进入,由(均填“A”或“B”)流出。
(2)圆底烧瓶中的物质(填“会”或“不会”)从冷凝管上口跑掉,是因为。
(3)合成实验中浓H2SO4的作用是。
碎瓷片的作用是。
(4)乙酸与异戊醇的物质的量之比0.35:0.14>1:1的原因是。
(5)在③中用蒸馏水多次洗涤的作用是。
④中用NaHCO3溶液洗涤产品的作用是。
实验室制取乙烯并检验乙烯性质的装置如下图。请回答有关问题:
 (1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是。
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是。 (2)烧瓶中产生乙烯的反应方程式为。
(2)烧瓶中产生乙烯的反应方程式为。 (3)反应开始后,可观察到C和D中共同的现象是; C中的反应类型为反应、D中的反应类型为反应。
(3)反应开始后,可观察到C和D中共同的现象是; C中的反应类型为反应、D中的反应类型为反应。 (4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是 ;10%的NaOH溶液起的作用是。
;10%的NaOH溶液起的作用是。
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。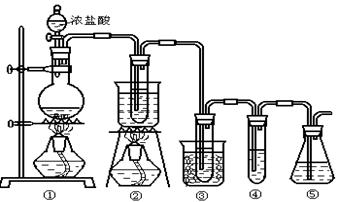
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是(填写实验操作名称)。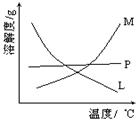
(3)本实验中制取次氯酸钠的离子方程式是:。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为色 |
氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为色 |
_________________________________________ |
一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。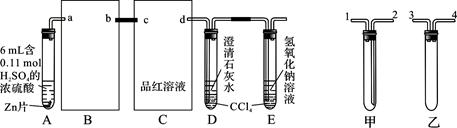
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:
____________________________________________________________________
(3)反应较长时间后气泡量又会明显增加的原因是________________________________
____________________________________。