如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。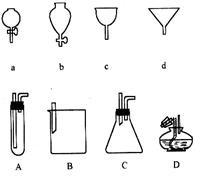
① A与 组合,用于 ,
② B与 组合,用于 ,
③ B与 组合,用于 ,
④ D与 组合,用于 ,
用如下图所示装置证明浓硫酸的强氧化性,并检验产物的性质。请回答:
(1)装置①中反应的化学方程式_______________________。
(2)装置②中的现象是_______________________。
(3)装置③中的现象可证明SO2有______________性。
(4)装置④中反应的离子方程式_________________。
(5)装置⑤的作用是____________________。
某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下3 组实验,如图Ⅰ~III 所示。
(1)Ⅰ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是___________(填化学式)。
(2)II、III 所示的实验均能鉴别这两种物质,相关反应的化学方程式是①_____________、②_________________。
③与II 相比, III 的优点是______________________(填选项序号)。
a.III 比II 复杂
b.III 比II 安全
c.III 可以做到用一套装置同时进行两个对比实验,而II 不行
(3)若用III 验证碳酸钠和碳酸氢钠的热稳定性,则试管B 中装入的固体应该是_______________。
某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用。他们进行了两组实验,过程如下:
过程Ⅰ:
过程Ⅱ:
(1)废Cu粉中一定含有的杂质是___________________(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:
①_______________________________________;
③_______________________________________;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)=_________,m(Cu)= _________;
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。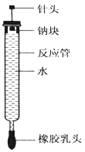
(1)钠与水反应的离子方程式为______________________;
(2)实验中“钠块熔化为闪亮的小球”说明____________________;向烧杯中的溶液中滴加________________,溶液变红,说明钠与水反应生成碱性物质;
(3)如果实验前加入反应管内水的体积为amL,欲使水最终全部被排出,则所取金属钠的质量至少为_______ g(设当时实验条件下气体摩尔体积为VmL/mol)。
某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
请回答下列问题:
Ⅰ.(1)实验时用10mol•L-1的浓硫酸,配制100mL 1mol•L-1 H2SO4溶液,所需浓硫酸的体积为_________mL;
(2)下列操作中,容量瓶所具备的功能有(填序号);
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在下列配制过程示意图中,有错误的是__________(填写序号);
(4)下列说法正确的__________
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
Ⅱ.(1)步骤②加入过量H2O2后,溶液中主要存在的金属阳离子是_____________;
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a.__________,b.洗涤,c.灼烧,d.冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为__________g。