( 8分)原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,
1mol Y2X2含有σ键的数目为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 。
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是 (填序号).
(2)①是________ ______ (填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________ 。
F1的结构简式是________________ 。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________ 。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和X,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料,写出X与足量新制的Cu(OH)2悬浊液反应的化学方程式:
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,则这两种单体的化学式是为___________________,______________________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: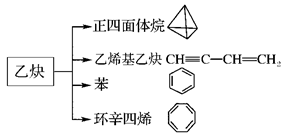
(1)正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法正确的是________。
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反应的化学方程式为
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式
(举两例):__________________、__________________。
请根据官能团的不同对下列有机物进行分类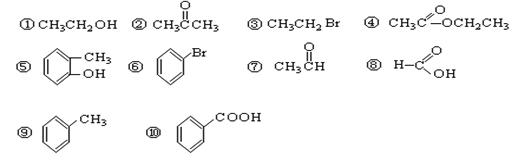
(1)芳香烃: ;(2)卤代烃: ;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯: 。
(Ⅱ)
⑴键线式 表示的分子式 。
表示的分子式 。
⑵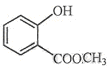 中含有的官能团的名称为 。
中含有的官能团的名称为 。
⑶书写该物质的名称:
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图:

(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 。
(2)沉淀池中发生反应的化学反应方程式是
从沉淀池中分离沉淀的操作是 。
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 。