食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少里K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 ___(只填化学式)。
(2)用提纯的NaCl配制500mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
③若收集的H2为2 L ,则同样条件下收集的Cl2 (填“>”、“=” 或“<” 2 L,原因是 。
2 L,原因是 。
已知:以铜做催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛溶液。下表给出甲醇、甲醛的沸点和水溶性:
| 沸点/℃ |
水溶性 |
|
| 甲醇 |
65 |
与水混溶 |
| 甲醛 |
-21 |
与水混溶 |
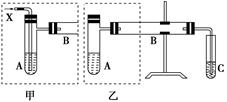
上图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示,请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是______________。
(2)若按甲装置进行实验,则通入A的X是________,B中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)若按乙装置进行实验,则B管中应装入的物质是________,B中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)试管C中应装入的试剂是
________________________________________________________________________。
(5)两套装置中都需要加热的仪器是________(填A、B或C)。
(6)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好?________(填“甲”或“乙”)。
(7)请设计简单的实验,检验实验后C中所得液体确为甲醛溶液。简述所用试剂、操作、现象及结论。
A、B、C三种物质的化学式都是C7H8O,若滴入FeCl3溶液,只有C呈紫色。若投入金属钠,只有B没有变化。
(1)写出A、B、C的结构简式:A______;B______;C________。
(2)C的另外两种同分异构体的结构简式是①________;②________。
实验室做甲醛和银氨溶液发生银镜反应的实验时:
(1)为产生光亮的银镜,试管应先用________溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
(2)配制银氨溶液时向盛有________溶液的试管中逐滴滴加________溶液,边滴边振荡直到________________________________________________________________________
为止。有关化学反应的离子方程式为:
①________________________________________________________________________。
②________________________________________________________________________。
(3)加热时应用________加热,产生银镜的化学方程式:
________________________________________________________________________。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱,但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为______________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式__________________________。试解释在实验室不宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
________________________________________________________________________
________________________________________________________________________。
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为:
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。