元素周期表中前7周期的元素种数如下:
| 周期 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 元素种数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
请分析周期表与元素种数的关系,然后预言第8周期最多可能含有的元素种数是( )
A.18 B.32 C.50 D.64
下列反应中生成物总能量高于反应物总能量的是
| A.酸碱中和反应 | B.乙醇在空气中完全燃烧 |
| C.锌放入稀硫酸中 | D.碳和水蒸气在高温下反应 |
根据化学反应实质是旧键的断裂和新键的形成过程,下列变化不属于化学变化的是
| A.白磷在隔绝空气的条件下,在260℃转化为红磷 |
| B.石墨在高温高压下转化为金刚石 |
| C.干冰转化为CO2气体 |
| D.固态S8加热到444.6℃时变成硫蒸气S2 |
一定质量的某有机物与足量的钠反应生成V1L气体。等量的该有机物与适量的纯碱(Na2CO3)反应,生成相同状况下的气体V2L。若V1>V2,那么该有机物可能是下列中的
| A.HO(CH2)2OH | B.HO(CH2)2COOH | C.HOOC-COOH | D.(CH3)3CCOOH |
关于苯乙烯(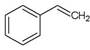 )的下列叙述,正确的是
)的下列叙述,正确的是
| A.苯乙烯不可能发生加成反应 |
| B.苯乙烯不可能使酸性高锰酸钾溶液褪色 |
| C.苯乙烯不可能使溴的四氯化碳溶液褪色 |
| D.苯乙烯可通过加聚反应生成高分子化合物 |
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是
| A.反应①是加成反应 | B.只有反应②是加聚反应 |
| C.只有反应⑦是取代反应 | D.反应④⑤⑥⑦是取代反应 |
