下列叙述正确的是( )
| A.同周期元素的离子半径从左到右逐渐减小 |
| B.同主族元素的离子半径从上到下逐渐增大 |
| C.同周期元素从左到右,金属性逐渐增强,非金属性逐渐减弱 |
| D.同主族元素的单质的熔点从上到下逐渐升高 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且1mol O2的化学键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为()
| A.188kJ | B.436kJ | C.557kJ | D.920kJ |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H 2O,发生反应:
2O,发生反应:
CO(g)+H2O(g)  CO2+
CO2+ H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是()
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g) N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的()
N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的()
| A.容器内气体颜色先变深后变浅,最后比原来还要浅 |
| B.反应向正反应方向移动 |
| C.NO2的转化率变小 |
| D.N2O4的体积分数一定增大 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是()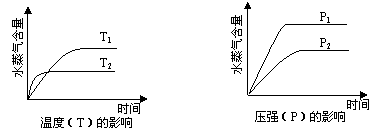
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0 |
B.CO2(g) + H2(g) CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0 |
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0 |
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 |
已知700K时,N2+3H2 2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是()
2NH3ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是()
| A.Q = Q1 = 1/2Q2 | B.Q>Q1>2Q2 |
| C.Q>2Q2>Q1 | D.Q = Q1 =Q2 |