(1)(5分)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
①该有机物的最简式 。
②若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为 。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知: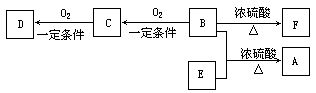
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E
分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有 (选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是 、 。
③写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④写出B和E反应生成A的化学方程式是: 。
⑤写出C与银氨溶液反应的化学方程式: 。
对于工业制硫酸中接触室内的反应:2SO2(g)+O2 (g)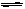 2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
| A.升高温度 | B.恒温、恒容充入氧气 |
| C.恒温恒容充入SO3 | D.加入催化剂V2O5 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是:
| A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应 |
| B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 |
| C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 |
| D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率 |
下列关于工业生产的说法中正确的是:
A.氯碱工业中阳离子交换膜的主要作用是:防止阳极产生的氯气和阴极产生的 氢气及氢氧化钠反应 氢气及氢氧化钠反应 |
| B.硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 |
| C.电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
| D.工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 |
下列说法不正确的是:
| A.煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 |
| B.测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义。 |
| C.利用盐类的水解反应可以制备胶体、对饮用水进行净化,也可以获得纳米材料。 |
| D.化学电池必须回收处理,其主要目的就是回收碳棒再利用。 |