工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
X、Y、Z、W、R是原子序数依次增大的五种短周期元素,化合物XZ、Y2W能破坏水的电离平衡,XR能抑制水的电离,则Y元素为
| A.Li | B.F | C.Na | D.S |
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
| A.糖类、蛋白质、油脂都属于天然高分子化合物 |
| B.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
| C.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| D.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
一定量的Fe和Fe2O3混合物投入1 mol·L-1 300 mL的HNO3溶液中,反应完全后,无固体剩余,生成1.12 LNO气体(标准状况),再向反应后溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
| A.200mL | B.245mL | C.250mL | D.300mL |
下列离子方程式,正确的是
| A.等物质的量的SO2与氢氧化钠溶液反应:SO2+OH-=HSO3- |
| B.用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2+H2O |
| C.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+CO32- |
D.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2+4H+ 2Cu+O2+4H+ |
某化学兴趣小组设计以下实验方案,可从样品中提取粗产品: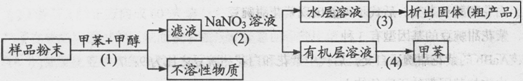
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |