(每空1分 共10分) A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2) D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是 。
(4)画出D的核外电子排布图_________________________________________,这样排布遵循了 原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
(16分)图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。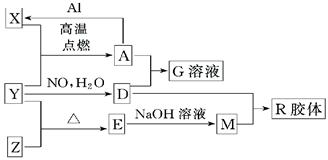
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是;M中存在的化学键类型为;R的化学式是。
⑵一定条件下,Z与H2反应生成ZH4,ZH4的电子式为。
⑶已知A与1molAl反应转化为X时(所有物质均为固体)。放出a KJ热量。写出该反应的热化学方程式:。
⑷写出A和D的稀溶液反应生成G的离子方程式:若转移0.6mol电子,生成的气体在标况下体积为
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
6—羰基庚酸是合成某些高分子材料和药物的重要的中间体。某实验室以溴代甲基环己烷为原料合成6—羰基庚酸,请用合成反应流程图表示出最合理的合成方案(注明反应条件)
提示:①合成过程中无机试剂任选②如有需要,可以利用试卷中出现过的信息
③合成反应流程图表示方法示例如下:
在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为: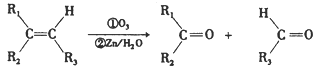
已知:
①合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或NaOH溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与NaOH溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
⑴写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中的一组)
A______________,C_____________,E________________.
⑵写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式:______________________________________________
已知醛在一定条件下可以发生如下转化: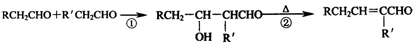
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题: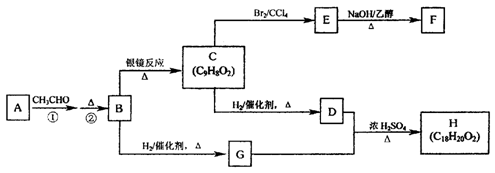
(1)A、B的结构简式为:AB。
(2)G、D反应生成H的化学方程式是:。
(3)一定条件下,能够与1molF发生反应的H2的最大用量是mol。
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为:。
分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,丙烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1mol H2,若甲还能与NaHCO3溶液反应,则甲的结构简式为;若甲还能发生银镜反应,则甲的结构简式为。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为:。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,则丙结构简式为。