用31.6g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸,反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
⑴该盐酸的物质的量浓度为 ?
⑵有 mol HCl被氧化?
⑶产生的Cl 2在标准状况下的体积为 ?
在常温下,将1体积氮气和一定量的氧气混和,测得混和气体对氢气的相对密度为14.5,求氧气所占的体积。
取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66 g,并有气体放出。试计算:
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度。
(2)产生的气体在标准状况下的体积。
19.0 g Na2CO3和NaHCO3的混合物与足量HCl(aq)反应,得到标准状况下的CO2气体4.48 L。试求:
(1)混合物中各成分的质量。
(2)如果HCl(aq)的浓度为0.500 mol·L-1,则所需HCl(aq)的体积至少是多少?
一个密闭容器,中间有一可自由滑动的隔板(厚度或忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共9g时,隔板处于如图位置(左、右两侧温度相同),求混合气体中CO和CO2的分子个数比。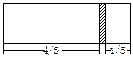
我国规定食盐的含碘量(按每千克食盐含碘元素计)为20mg·kg-1~40mg·kg-1,则每千克食盐加入碘酸钾(KIO3)的物质的量应不少于。