(9分)实验室用氯化钠固体配制1.0 mol·L-1的NaCl溶液500 mL,回答下列问题:
(1)实验所需玻璃仪器除玻烧杯、璃棒、量筒外还有 和
(2)使用容量瓶前首先要
(3) 下列操作对所配溶液的浓度有何影响?(填写字母)
①偏大的有_______________________________________________;
②偏小的有_______________________________________________;
③无影响的有_____________________________________________。
| A.未洗涤溶解NaCl的烧杯 |
| B.往容量瓶中移液时,有少量液体溅出 |
| C.定容时俯视刻度线 |
| D.容量瓶用蒸馏洗涤后残留有少量的水 |
E.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答:
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: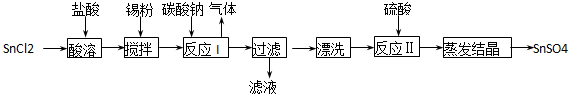
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:_______________;加入锡粉的作用是:_______________;
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:_______________;
(3) 检验沉淀已经“洗涤”干净的操作是:______________________________;
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH _______________。(已知:Ksp[Sn (OH)2]=1.0×10-26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:_______________。
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_______;
(2)通气后,应先点燃________处的酒精灯,再点燃________处的酒精灯,如果同时点燃A、F装置的酒精灯,对实验结果的影响为________;装置F的作用为________。
(3)请设计一个实验,验证产物是氮化镁:_____________________;
(4)已知Mg3N2是离子化合物,证明Mg3N2是离子化合物实验依据是________________。
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是 。
实验二: 制取水合肼。(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
蒸馏时需要减压,原因是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是__________。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2=2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式: 。
某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请指出: 。
某学生为了测定部分变质的Na2SO3样品的纯度。按右图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4至完全反应;然后,将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、______________、______________。
(2)实验开始时,应先点燃__________________处酒精灯(填装置字母)。
(3) 写出D中反应的化学方程式__________________________________。
(4)实验开始后,写出B中反应的离子方程式_______________________。
(5)C中的现象是____________________,E装置的作用是__________________。
(6)原样品中Na2SO3的纯度为__________(精确到0.1%)。按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度_____(填“偏高”、“偏低”或“无影响”)。